
【题目】已知NaHCO3的溶解度较小。在饱和的NH3和NaCl的混合溶液中通入CO2,可析出NaHCO3(固体):NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。据此,我国杰出的化学家侯德榜设计出了生产纯碱的方法:
饱和NaCl(溶液)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
这种方法被人们称为侯氏制碱法,打破了帝国主义对我国经济的一种封锁,大长了中国人的民族志气。
试回答下列问题:
(1)写出由NaHCO3固体制取Na2CO3的化学方程式:__________________。
(2)如果Na2CO3(固体)中混有NaHCO3(固体),应如何除去?_____________(写出方法);如果NaHCO3(溶液)中混有Na2CO3(溶液),应如何除去?________(写出化学方程式)。
【答案】2NaHCO3![]() Na2CO3+H2O+CO2↑ 加热 Na2CO3+H2O+CO2=2NaHCO3
Na2CO3+H2O+CO2↑ 加热 Na2CO3+H2O+CO2=2NaHCO3
【解析】
(1) 根据NaHCO3固体受热容易分解书写反应的方程式;
(2) NaHCO3固体受热容易分解生成Na2CO3,Na2CO3在溶液中可以与二氧化碳反应生成碳酸氢钠据此分析解答。
(1) NaHCO3固体受热容易分解生成Na2CO3,反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(2) NaHCO3固体受热容易分解生成Na2CO3,Na2CO3(固体)中混有NaHCO3(固体)可以通过加热的方法除去;如果NaHCO3(溶液)中混有Na2CO3(溶液),可以在溶液中通入二氧化碳气体,Na2CO3+H2O+CO2=2NaHCO3,故答案为:加热;Na2CO3+H2O+CO2=2NaHCO3。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如右下图所示的关系。下列说法不正确的是

A. 离子半径大小关系:Y>Z>X>W
B. YX2遇到蓝色石蕊试液先变红后褪色
C. 简单阴离子的还原性:Y>Z
D. Y与Z属于同一周期,与X属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①温度T1时,0~0.5 min内的反应速率v(CO)=________________。
②b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
③下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性,此时溶液中含硫微粒浓度的大小关系为________________。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释相关的离子方程式错误的是
A. H2S溶于水:H2S+H2O![]() HS-+H3O+
HS-+H3O+
B. 向Na2S2O3溶液中加入稀硫酸:S2O3-+2H+=S↓+SO2↑+H2O
C. NH4Cl溶液呈酸性:NH4++H2O=NH3·H2O+H+
D. K2Cr2O7溶于水:Cr2O7-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向40mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如下图所示:
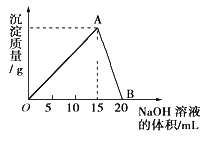
(1)写出AB段发生反应的离子方程式___________。
(2)A点表示的意义是__________。
(3)当所得沉淀量为0.39g时,用去NaOH溶液的体积是_______ mL。
(4)向B点处的溶液中通入少量CO2会有什么现象________写出离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. MnO2与浓盐酸混合加热:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B. NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+=Fe3++2H2O
D. Ca(HCO3)2溶液中加入过量氨水:Ca2++HCO3-+NH3·H2O=CaCO3↓+H2O+NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是_____________①_____________________________.
发生反应的化学方程式是_______________②_______________________;
(2)B中加入的物质是_____③________,其作用是_________④_______________:
(3)实验时在C中观察到得现象是_____________⑤_________________,
发生反应的化学方程式是_________________⑥____________________;
(4) 实验时在D中观察到得现象是________________⑦__________________,
D中收集到的物质是_______⑧_______,检验该物质的方法和现象是_________⑨_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列说法正确的是

A. b点溶液中不可能存在NH3·H2O
B. b、c两点pH相同,但溶液的酸碱性不同
C. 通过降温的方法,可使溶液的状态中d点变为a点
D. a点溶液中可能大量共存的离子:Fe3+、Na+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com