
【题目】已知:H2SO3![]() HSO3-+H+ Kal;HSO3-
HSO3-+H+ Kal;HSO3-![]() SO32-+H+ Ka2。25℃时,向某浓度的H2SO3溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法错误的是
SO32-+H+ Ka2。25℃时,向某浓度的H2SO3溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法错误的是
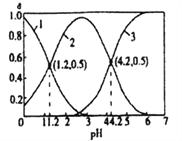
A. 曲线3表示的微粒是SO32-
B. 25℃时,Kal/ Ka2=1000
C. 溶液的pH=1.2时,溶液中有c(Na+)+c(H+)=c(OH-)+c(H2SO3)
D. 溶渡的Ph=4.2时,溶液中有c(Na+)+c(H+)=c(OH-)+2c(SO32-)
【答案】D
【解析】A、由图象可知,溶液pH越大,曲线3表示的离子的物质的量分数逐渐增大,则曲线3表示的微粒是SO32-,选项A正确;B、25℃时,坐标(1.2,0.5)时H2SO3、HSO3-的含量相同,则![]() ,坐标(4.2,0.5)时SO32-、HSO3-的含量相同,则
,坐标(4.2,0.5)时SO32-、HSO3-的含量相同,则![]() ,
, ![]() ,选项B正确;C、溶液的pH=1.2时,此时溶液中的亚硫酸根离子的浓度为0,H2SO3、HSO3-的含量相同浓度相同,而根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以c(Na+)+c(H+)=c(OH-)+c(H2SO3),选项C正确;D、溶渡的Ph=4.2时,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),选项D错误。答案选D。
,选项B正确;C、溶液的pH=1.2时,此时溶液中的亚硫酸根离子的浓度为0,H2SO3、HSO3-的含量相同浓度相同,而根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以c(Na+)+c(H+)=c(OH-)+c(H2SO3),选项C正确;D、溶渡的Ph=4.2时,根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),选项D错误。答案选D。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 、△S>0
B. N2(g)+3H2(g)![]() 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
C. 水解反应NH4++H2O![]() NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
D. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目______________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______MnO4-+______Fe2++______H+=______Mn2++______Fe3++______H2O。
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示图象中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,表示向MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量的图象是( )
A. 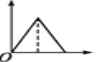 B.
B. 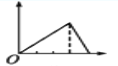 C.
C. 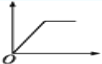 D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO42-![]()
B. 检验试液中的Fe2+![]()
C. 检验试液中的I-![]()
D. 检验试液中的CO32-![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见碱
①下列事实可证明氨水是弱碱的是________(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1mol/L氨水pH为11
C.铵盐受热易分解
D.常温下,0 1mol/L氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是______(填学母序号)。
A.通入氨气 B.如入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)25℃,在0.1mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,密液pH与c(S2-
关系如下图(忽略溶液体积的变化、H2S的挥发)。
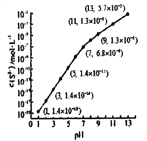
①pH=13 时,溶液中的c(H2S)+c(HS-)=______mol/L。
②某溶液含0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=____时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)聚合硫酸铁(PFS) 是水处理中重要的絮凝剂。盐基度B是衡量絮凝剂紫凝效果的重要指标,定义式为B=3n(OH-)/n(Fg3+)(n为物质的量)。为测量样品的B值。取样品mg,准确加入过量盐酸,充分反应,再加入点沸后冷却的蒸馏水,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液VmL。按照上述步骤做空白对照试验,消耗NaOH溶液V0mL已知该样品中Fe的质量分数w,则B 的表达式为_________。
(4)常温时,若Ca(OH)2和CaWO4 (钨酸钙) 的沉淀溶解平衡曲线如图所示(已知: ![]() =0.58)。
=0.58)。
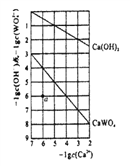
①a点表示Ca(OH)2和CaWO4________(填“是”或“否”)达到溶解平衡,说 明理由_______________。
②饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合,写出混合溶液中各离了浓度大小关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1molL-1NaHCO3溶液的pH=8.31,有关该溶液的判断正确的是
A. c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
B. Ka1(H2CO3)Ka2(H2CO3)<KW
C. c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-)
D. 加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com