
【题目】某研究性学习小组为了解有机物A的性质,对A的结构进行了如下实验。
实验一:通过质谱分析仪分析得知有机物A的相对分子质量为90。
实验二:用红外光谱分析发现有机物A中含有-COOH和-OH。
实验三:取1.8g有机物A完全燃烧后,测得生成物为2.64gCO2和1.08gH2O。
实验四:经核磁共振检测发现有机物A的谱图中H原子峰值比为3:1:1:1。
(1)有机物A的结构简式为__。
(2)有机物A在一定条件下可以发生的反应有__。
a.消去反应 b.取代反应 c.聚合反应 d.加成反应 e.氧化反应
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B的分子式为C3H4O2,B能和溴发生加成反应,则B的结构简式为__。另一种产物C是一种六元环状酯,写出生成C的化学方程式:__。
【答案】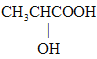 abce CH2=CHCOOH 2
abce CH2=CHCOOH 2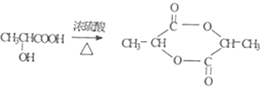 +2H2O
+2H2O
【解析】
(1)有机物A的相对分子质量为90,含有-COOH和-OH,那么只能有一个羧基,实验三:取1.8g有机物A完全燃烧后,测得生成物为2.64gCO2和1.08gH2O,0.02molA完全燃烧后生成二氧化碳0.06molCO2和0.06mol H2O,所以碳原子的物质的量是0.06mol,氢原子的物质的量是0.12mol,所以有机物分子中碳原子个数是3,氢原子个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为C3H6O2,实验四:经核磁共振检测发现有机物A的谱图中H原子峰值比为3:1:1:1,分子里有四种不同的氢原子,且数目比为为3:1:1:1,则A为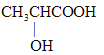 ;
;
(2)A在一定条件下可以发生的反应类型由官能团决定;
(3)A为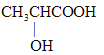 ,在浓硫酸作用下可生成一种产物B的分子式为C3H4O2,这是浓硫酸作用下的消去反应,生成碳碳双键,B是丙烯酸, A在浓硫酸作用下可生成一种产物C是一种六元环状酯,应是2分子A之间反应生成,据此写反应方程式;
,在浓硫酸作用下可生成一种产物B的分子式为C3H4O2,这是浓硫酸作用下的消去反应,生成碳碳双键,B是丙烯酸, A在浓硫酸作用下可生成一种产物C是一种六元环状酯,应是2分子A之间反应生成,据此写反应方程式;
(1)据上分析可知有机物A的结构简式为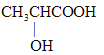 ;
;
答案为: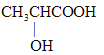 ;
;
(2)有机物A含有-COOH和-OH,在一定条件下-COOH和-OH即可以酯化反应,酯化反应属于取代反应,又可以缩聚成聚乳酸,羟基还可以发生可以发生消去反应和氧化反应;
答案为:a b c e;
(3)B的分子式为C3H4O2,B能和溴发生加成反应,是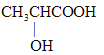 在浓硫酸作用下消去反应生成的产物,其中一种产物,则B的结构简式为CH2=CHCOOH;
在浓硫酸作用下消去反应生成的产物,其中一种产物,则B的结构简式为CH2=CHCOOH;
答案为:CH2=CHCOOH;
A在浓硫酸作用下可生成一种产物C是一种六元环状酯,是一个A分子的羧基和另一个A分子的羟基之间发生酯化反应形成的,生成C的化学方程式为:
 ;
;
答案为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
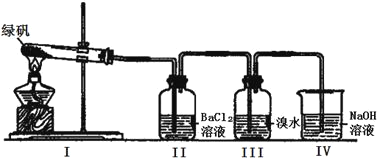
(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
_________________________ |
步骤二:______________ |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示物质间的转化均能实现的是( )
A.CH3CH2CH2Br![]() CH3CH=CH2
CH3CH=CH2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
B.NaOH(aq)![]() C6H5ONa(aq)
C6H5ONa(aq)![]() NaHCO3(aq)
NaHCO3(aq)
C.NaOH(aq)![]() Cu(OH)2浑浊液
Cu(OH)2浑浊液![]() Cu2O(s)
Cu2O(s)
D.石油![]() CH3CH=CH2
CH3CH=CH2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
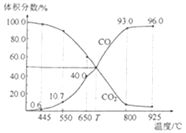
A.550℃时,若充入稀有气体,v正、v逆均减小,平衡不移动
B.T℃时,反应达平衡后CO2的转化率为50%
C.T℃时,若充入等体积的CO2和CO,平衡不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期目的是( )
实验操作 | 实验目的 | |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 苯酚和水的浊液中,加少量浓碳酸钠溶液 | 比较苯酚与碳酸氢钠的酸性 |
D | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素金属性、非金属性的说法正确的是( )
A.![]() 的酸性强于
的酸性强于![]() ,故非金属性:
,故非金属性:![]()
B.第ⅠA族金属元素是同周期中金属性最强的元素
C.仅用![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,无法验证
溶液,无法验证![]() 、
、![]() 的金属性强弱
的金属性强弱
D.第ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同一原子中,![]() 、
、![]() 、
、![]() 电子的能量逐渐减小
电子的能量逐渐减小
B.同一原子中,![]() 上的电子较
上的电子较![]() 上的电子离核远
上的电子离核远
C.能量高的电子在离核近的区域运动,能量低的电子在离线远的区域运动
D.各能层含有的能级数为![]() (
(![]() 为能层序数)
为能层序数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔为原料在不同条件下可以合成多种有机物.
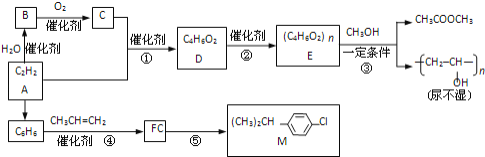
已知:①CH2=CHOH(不稳定)![]() CH3CHO
CH3CHO
②一定条件下,醇与酯会发生交换反应:RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
完成下列填空:
(1)写反应类型:③__反应;④__反应.反应⑤的反应条件__.
(2)写出反应方程式.B生成C__;反应②__.
(3)R是M的同系物,其化学式为![]() ,则R有__种.
,则R有__种.
(4)写出含碳碳双键、能发生银镜反应且属于酯的D的同分异构体的结构简式__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,2L密闭容器中,金属钠和CO2可制得金刚石:4Na+3CO22Na2CO3+C(s,金刚石)。
(1)上述反应中涉及的元素原子的半径从大到小的顺序为:___。
(2)能证明碳元素与氧元素非金属性强弱的事实是___(选填编号)。
a.最高价氧化物水化物的酸性 b.两种元素的气态氢化物的沸点
c.CO2中元素的化合价 d.与氢气反应的难易程度
(3)高压下,科学家成功地将CO2转化为具有类似SiO2结构的原子晶体,比较两种原子晶体的熔沸点:___,并说明理由:___。除了金刚石外,碳的单质还有许多同素异形体,比如石墨、C60等。石墨烯是由碳原子构成的单层片状结构的新材料,可由石墨剥离而成,是目前发现的最薄、强度最大、导电导热性能最强的一种新材料。
(4)石墨烯中的碳原子间以___键结合,下列关于石墨烯的叙述正确的是___。
A.石墨烯与石墨属于同位素
B.石墨烯与石墨完全燃烧的产物都是二氧化碳
C.石墨烯是一种烯烃。
D.12g石墨烯中含有6.02×1022个碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com