
【题目】(1)已知短周期元素![]() 、
、![]() ,
,![]() 元素原子的最外层电子数为
元素原子的最外层电子数为![]() ,次外层电子数为
,次外层电子数为![]() ;
;![]() 元素原子的
元素原子的![]() 层(有电子)电子数为
层(有电子)电子数为![]() ,
,![]() 层电子数为
层电子数为![]() ,则
,则![]() 为______(填元素符号,下同),
为______(填元素符号,下同),![]() 为______.
为______.
(2)已知![]() 元素原子的
元素原子的![]() 层比
层比![]() 元素原子的
元素原子的![]() 层少3个电子,
层少3个电子,![]() 元素原子的核外电子总数比
元素原子的核外电子总数比![]() 元素原子的多5,则
元素原子的多5,则![]() 、
、![]() 分别为______、______。
分别为______、______。
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
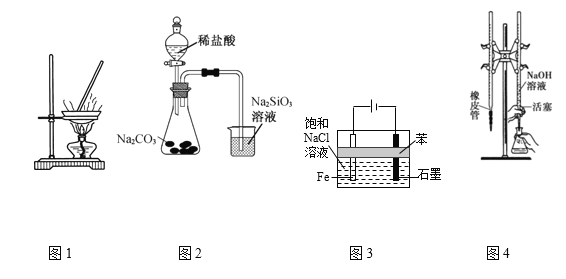
A.用图1装置蒸发CuCl2溶液获得无水CuCl2
B.用图2装置可证明非金属强弱:Cl>C>Si
C.用图3装置制备少量白色的Fe(OH)2沉淀
D.用图4装置进行已知浓度的NaOH溶液测定未知浓度的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
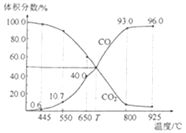
A.550℃时,若充入稀有气体,v正、v逆均减小,平衡不移动
B.T℃时,反应达平衡后CO2的转化率为50%
C.T℃时,若充入等体积的CO2和CO,平衡不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素金属性、非金属性的说法正确的是( )
A.![]() 的酸性强于
的酸性强于![]() ,故非金属性:
,故非金属性:![]()
B.第ⅠA族金属元素是同周期中金属性最强的元素
C.仅用![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,无法验证
溶液,无法验证![]() 、
、![]() 的金属性强弱
的金属性强弱
D.第ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同一原子中,![]() 、
、![]() 、
、![]() 电子的能量逐渐减小
电子的能量逐渐减小
B.同一原子中,![]() 上的电子较
上的电子较![]() 上的电子离核远
上的电子离核远
C.能量高的电子在离核近的区域运动,能量低的电子在离线远的区域运动
D.各能层含有的能级数为![]() (
(![]() 为能层序数)
为能层序数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂因其重要的用途,被誉为“能源金属”和“推动世界前进的金属”.
(1)Li3N可由Li在N2中燃烧制得.取4.164g 锂在N2中燃烧,理论上生成Li3N__g;因部分金属Li没有反应,实际反应后固体质量变为6.840g,则固体中Li3N的质量是__g(保留三位小数,Li3N的式量:34.82)
(2)已知:Li3N+3H2O→3LiOH+NH3↑.取17.41g纯净Li3N,加入100g水,充分搅拌,完全反应后,冷却到20℃,产生的NH3折算成标准状况下的体积是__L.过滤沉淀、洗涤、晾干,得到LiOH固体26.56g,计算20℃时LiOH的溶解度__.(保留1位小数,LiOH的式量:23.94)
锂离子电池中常用的LiCoO2,工业上可由碳酸锂与碱式碳酸钴制备.
(3)将含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,充分反应后得到碱式碳酸钴沉淀53.50g;过滤,向滤液中加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,经测定溶液中的阳离子只有Na+,且Na+有1mol;反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,通过计算确定该碱式碳酸钴的化学式__,写出制备碱式碳酸钴反应的化学方程式__.
(4)Co2(OH)2CO3和Li2CO3在空气中保持温度为600~800℃,可制得LiCoO2,已知: 3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
按钴和锂的原子比1:1混合固体,空气过量70%,800℃时充分反应,计算产物气体中CO2的体积分数__.(保留三位小数,已知空气组成:N2体积分数0.79,O2体积分数0.21)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔为原料在不同条件下可以合成多种有机物.
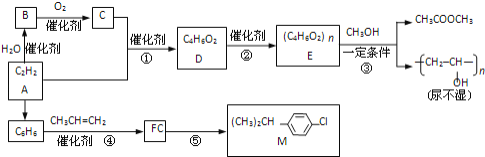
已知:①CH2=CHOH(不稳定)![]() CH3CHO
CH3CHO
②一定条件下,醇与酯会发生交换反应:RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
完成下列填空:
(1)写反应类型:③__反应;④__反应.反应⑤的反应条件__.
(2)写出反应方程式.B生成C__;反应②__.
(3)R是M的同系物,其化学式为![]() ,则R有__种.
,则R有__种.
(4)写出含碳碳双键、能发生银镜反应且属于酯的D的同分异构体的结构简式__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式可能与事实相符的是
A.OH﹣+2CO32﹣+3H+→2HCO3﹣+H2O
B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O
D.OH﹣+CO32﹣+3H+→CO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
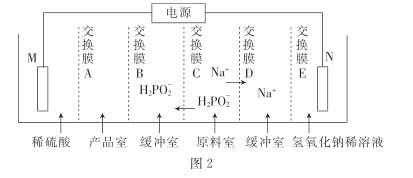
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性.都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反应N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
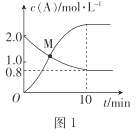
①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_______。
②M点时,N2H4的转化率为______(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡______(填“正向移动”“逆向移动”或“不移动”)。
(3)①在惰性气体中,将黄磷(P4)与石灰乳和碳酸钠溶液一同加入高速乳化反应器中制得NaH2PO2,同时还产生磷化氢(PH3)气体,该反应的化学方程式为________________。
②次磷酸(H3PO2)是一元酸,常温下.1.0 mol●L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=___________。
③用次磷酸钠通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于____(填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为______,当电路中流过3.8528×105库仑电量时.制得次磷酸的物质的量为_____ (一个电子的电量为 1.6×10- 19库仑,NA数值约为6. 02× 1023)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com