
【题目】锂因其重要的用途,被誉为“能源金属”和“推动世界前进的金属”.
(1)Li3N可由Li在N2中燃烧制得.取4.164g 锂在N2中燃烧,理论上生成Li3N__g;因部分金属Li没有反应,实际反应后固体质量变为6.840g,则固体中Li3N的质量是__g(保留三位小数,Li3N的式量:34.82)
(2)已知:Li3N+3H2O→3LiOH+NH3↑.取17.41g纯净Li3N,加入100g水,充分搅拌,完全反应后,冷却到20℃,产生的NH3折算成标准状况下的体积是__L.过滤沉淀、洗涤、晾干,得到LiOH固体26.56g,计算20℃时LiOH的溶解度__.(保留1位小数,LiOH的式量:23.94)
锂离子电池中常用的LiCoO2,工业上可由碳酸锂与碱式碳酸钴制备.
(3)将含0.5molCoCl2的溶液与含0.5molNa2CO3的溶液混合,充分反应后得到碱式碳酸钴沉淀53.50g;过滤,向滤液中加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,经测定溶液中的阳离子只有Na+,且Na+有1mol;反应中产生的气体被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,通过计算确定该碱式碳酸钴的化学式__,写出制备碱式碳酸钴反应的化学方程式__.
(4)Co2(OH)2CO3和Li2CO3在空气中保持温度为600~800℃,可制得LiCoO2,已知: 3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
按钴和锂的原子比1:1混合固体,空气过量70%,800℃时充分反应,计算产物气体中CO2的体积分数__.(保留三位小数,已知空气组成:N2体积分数0.79,O2体积分数0.21)
【答案】6.964 6.656 11.2 12.8g 2CoCO33Co(OH)2H2O 5CoCl2+5Na2CO3+4H2O=2CoCO33Co(OH)2H2O+10NaCl+3CO2↑ 0.305
【解析】
(1)首先写出锂在氮气中燃烧的方程式:![]() ,接下来根据
,接下来根据![]() 算出锂的物质的量,则理论上能生成0.2mol的氮化锂,这些氮化锂的质量为
算出锂的物质的量,则理论上能生成0.2mol的氮化锂,这些氮化锂的质量为![]() ;反应前后相差的质量为
;反应前后相差的质量为![]() ,这些增加的质量实际上是氮原子的质量,即
,这些增加的质量实际上是氮原子的质量,即![]() 的氮原子,根据氮守恒我们知道氮化锂的物质的量也为
的氮原子,根据氮守恒我们知道氮化锂的物质的量也为![]() ,这些氮化锂的质量为
,这些氮化锂的质量为![]() ;
;
(2)根据![]() 先算出氮化锂的物质的量,根据方程式不难看出氮化锂和氨气是1:1的,这些氨气在标况下的体积为
先算出氮化锂的物质的量,根据方程式不难看出氮化锂和氨气是1:1的,这些氨气在标况下的体积为![]() ;根据化学计量比,0.5mol的氮化锂理论上能生成1.5mol的
;根据化学计量比,0.5mol的氮化锂理论上能生成1.5mol的![]() ,这些
,这些![]() 的质量为
的质量为![]() ,缺少的那9.35克
,缺少的那9.35克![]() 即溶解损失掉的,但是需要注意:溶解度指的是100克溶剂能溶解达到饱和的最大溶质的量,虽然一开始有100克水,但是反应会消耗掉1.5mol水,这些水的质量为
即溶解损失掉的,但是需要注意:溶解度指的是100克溶剂能溶解达到饱和的最大溶质的量,虽然一开始有100克水,但是反应会消耗掉1.5mol水,这些水的质量为![]() ,因此我们算出的9.35克是73克水中能溶解的
,因此我们算出的9.35克是73克水中能溶解的![]() 的量,换算一下
的量,换算一下![]() ,解得S为12.8克;
,解得S为12.8克;
(3)加入硝酸银后的白色沉淀为![]() ,根据
,根据![]() 算出
算出![]() 的物质的量,因此
的物质的量,因此![]() 全部留在溶液中,碱式碳酸钴中无
全部留在溶液中,碱式碳酸钴中无![]() ,
,![]() 也全部留在溶液中,沉淀中无
也全部留在溶液中,沉淀中无![]() ,使烧碱溶液增重是因为吸收了
,使烧碱溶液增重是因为吸收了![]() ,根据
,根据![]() 算出
算出![]() 的物质的量,根据碳守恒,剩下的
的物质的量,根据碳守恒,剩下的![]()
![]() 进入了碱式碳酸钴中,0.5mol
进入了碱式碳酸钴中,0.5mol![]() 全部在碱式碳酸钴中,剩下的负电荷由
全部在碱式碳酸钴中,剩下的负电荷由![]() 来提供,因此
来提供,因此![]() 的物质的量为0.6mol。将0.5mol
的物质的量为0.6mol。将0.5mol![]() 、0.2mol
、0.2mol![]() 和0.6mol
和0.6mol![]() 的质量加起来,发现只有
的质量加起来,发现只有![]() ,剩下的1.8克只能是结晶水,即0.1mol结晶水,综上,碱式碳酸钴的分子式为
,剩下的1.8克只能是结晶水,即0.1mol结晶水,综上,碱式碳酸钴的分子式为![]() ;写出制备方程式
;写出制备方程式![]() ;
;
(4)令参加反应的氧气为3mol,相当于![]() 的空气,又因为空气过量70%,则一共通入了
的空气,又因为空气过量70%,则一共通入了![]() 空气,反应中一共生成了6mol水蒸气和12mol二氧化碳,则二氧化碳的体积分数为
空气,反应中一共生成了6mol水蒸气和12mol二氧化碳,则二氧化碳的体积分数为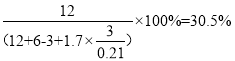 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氧气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知儿种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH=___kJ·mol-1。
N2(g)+2H2O(g) ΔH=___kJ·mol-1。
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2:H2O2(g)+H2(g)![]() 2H2O(g)。
2H2O(g)。
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,活化能较大的是反应___(填“l”或“2”)。c(NO)对总反应速率的影响程度___c(H2)(填“大于”“小于”或“等于”)。
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)。
7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是___(填字母)。
A.混合气体密度保持不变 B.NO2和N2的消耗速率之比为6:7
C.混合气体中c(N2)=c(NO2) D.混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
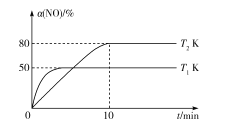
(4)下列说法正确的是___(填字母)。
A.图像中,T1>T2
B.上述反应在高温下能自发进行
C.10min时,T2K下正、逆反应速率相等
D.增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=___mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=___L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则平衡___(填“向右移动”“向左移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上CO2、CH4等含碳化合物有着重要的应用。
(1)科学家以CH4为原料来制备乙烯,同时得到氢气。已知相关物质的标准燃烧热如下表所示,写出甲烷制备乙烯的热化学方程式:__。
物质 | 标准燃烧热/kJ·mol-1 |
氢气 | -285.8 |
甲烷 | -890.3 |
乙烯 | -1411.0 |
(2)在400℃时,向初始体积为1L的恒容密闭反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。
①该温度下,平衡常数K=__。
②若向该平衡体系中充入等物质的量的CH4和H2,则平衡将___(填“正向移动”或“逆向移动”或“不移动”成“无法确定”),理由是__。
(3)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现CO2的再利用。
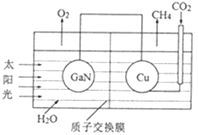
①该电化学装置属于__(填“原电池”或“电解池”)。
②该电池的Cu电极上发生反应的电极方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常温下0.1 mol/L氨水(pH=11)的说法正确的是
A.该氨水显弱碱性
B.加水稀释过程中,![]() 的值减小
的值减小
C.与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+)
D.加入少量NH4Cl 固体,溶液中水的电离平衡:H2O![]() H+ + OH―向右移动
H+ + OH―向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知短周期元素![]() 、
、![]() ,
,![]() 元素原子的最外层电子数为
元素原子的最外层电子数为![]() ,次外层电子数为
,次外层电子数为![]() ;
;![]() 元素原子的
元素原子的![]() 层(有电子)电子数为
层(有电子)电子数为![]() ,
,![]() 层电子数为
层电子数为![]() ,则
,则![]() 为______(填元素符号,下同),
为______(填元素符号,下同),![]() 为______.
为______.
(2)已知![]() 元素原子的
元素原子的![]() 层比
层比![]() 元素原子的
元素原子的![]() 层少3个电子,
层少3个电子,![]() 元素原子的核外电子总数比
元素原子的核外电子总数比![]() 元素原子的多5,则
元素原子的多5,则![]() 、
、![]() 分别为______、______。
分别为______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种有机化合物的结构简式:(选填序号,下同)
①CH3CH═CH﹣CH2CH3 ② ③CH3CH2﹣CH2﹣CH2OH ④CH3﹣C≡C﹣CH3 ⑤CH3﹣CH2﹣C≡CH ⑥
③CH3CH2﹣CH2﹣CH2OH ④CH3﹣C≡C﹣CH3 ⑤CH3﹣CH2﹣C≡CH ⑥![]()
⑦CH3CH2CH2OCH3 ⑧![]() ⑨CH2═CH﹣CH═CH2 ⑩CH2═CH﹣CH2CH2CH3
⑨CH2═CH﹣CH═CH2 ⑩CH2═CH﹣CH2CH2CH3
(1)互为同分异构体的是______________ (2)互为同系物的是___________
(3)官能团位置不同的同分异构体是_______ (4)官能团类型不同的同分异构体是__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
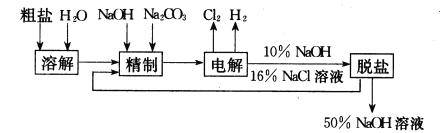
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应式为__________。 与电源负极相连的电极附近,溶液pH ________(选填:不变,升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________,
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 _________。
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、_________(填写操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com