
【题目】还原法处理氮的氧化物是环境科学研究的热点课题。
I.氧气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)![]() N2(g)+2H2O(g)。
N2(g)+2H2O(g)。
(1)已知儿种化学键的键能数据如下:

2NO(g)+2H2(g)![]() N2(g)+2H2O(g) ΔH=___kJ·mol-1。
N2(g)+2H2O(g) ΔH=___kJ·mol-1。
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2:H2O2(g)+H2(g)![]() 2H2O(g)。
2H2O(g)。
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,活化能较大的是反应___(填“l”或“2”)。c(NO)对总反应速率的影响程度___c(H2)(填“大于”“小于”或“等于”)。
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)。
7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是___(填字母)。
A.混合气体密度保持不变 B.NO2和N2的消耗速率之比为6:7
C.混合气体中c(N2)=c(NO2) D.混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2molCO和2molNO,测得NO的转化率与温度、时间的火系如图所示。
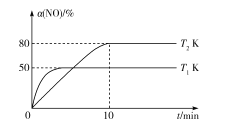
(4)下列说法正确的是___(填字母)。
A.图像中,T1>T2
B.上述反应在高温下能自发进行
C.10min时,T2K下正、逆反应速率相等
D.增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0-10min内用CO表示的平均反应速率v(CO)=___mol/L-1·min-1;T1K温度下,上述反应的平衡常数K=___L·mol-1。
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则平衡___(填“向右移动”“向左移动”或“不移动”)。
【答案】-666 1 大于 BD AC 0.08 1 向右移动
【解析】
(1)ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量;
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),总反应速率由反应较慢的一步决定,以此判断活化能大小;由反应速率表达式可知c(NO)对总反应速率的影响程度大于c(H2);
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),总反应速率由反应较慢的一步决定,以此判断活化能大小;由反应速率表达式可知c(NO)对总反应速率的影响程度大于c(H2);
(3)8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g)反应达到平衡则正反应速率等于逆反应速率,由此判断;
7N2(g)+12H2O(g)反应达到平衡则正反应速率等于逆反应速率,由此判断;
(4)由初始反应速率判断T1和T2的大小;反应能自发进行则![]() ;反应达到平衡则正反应速率等于逆反应速率;增大NO的浓度平衡正移,NO转化率减小;
;反应达到平衡则正反应速率等于逆反应速率;增大NO的浓度平衡正移,NO转化率减小;
(5)利用三段法计算反应速率,平衡常数K=![]() ;
;
(6)通过比较平衡常数K和浓度商Q来判断反应移动方向,若K<Q则反应向左移动,若K>Q则反应向右移动。
(1)ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g)
N2(g)+2H2O(g)![]() ,故答案为:-666;
,故答案为:-666;
(2)2NO(g)+2H2(g)![]() N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),
N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),
反应1:2NO(g)+H2(g)![]() N2(g)+H2O2(g);
N2(g)+H2O2(g);
反应2:H2O2(g)+H2(g)![]() 2H2O(g)。
2H2O(g)。
总反应速率由反应较慢的一步决定,则反应1反应速率慢活化能高,由反应速率表达式可知c(NO)对总反应速率的影响程度大于c(H2);故答案为:1;大于;
(3)恒容容器中8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(g),反应达到平衡,正反应速率等于逆反应速率故NO2和N2的消耗速率之比为6:7,B正确;反应为增压反应,容器中压强不变则可证明反应达到平衡,故D正确;A密度恒定不变,无法说明达到平衡;C c(N2)=c(NO2)浓度相等不等于反应速率相等,故C错误;故答案选BD。
7N2(g)+12H2O(g),反应达到平衡,正反应速率等于逆反应速率故NO2和N2的消耗速率之比为6:7,B正确;反应为增压反应,容器中压强不变则可证明反应达到平衡,故D正确;A密度恒定不变,无法说明达到平衡;C c(N2)=c(NO2)浓度相等不等于反应速率相等,故C错误;故答案选BD。
(4)对于反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
A.由图像可知初始反应速率T1>T2,则温度T1>T2,故A正确;
B. T1>T2平衡时转化率T1<T2,则ΔH<0,ΔS<0反应能自发进行则![]() ;则反应在低温下能自发进行,故B错误;
;则反应在低温下能自发进行,故B错误;
C. 10min时反应达到平衡,T2K下正、逆反应速率相等,故C正确;
D. 增大NO的浓度平衡正移,NO转化率减小,故D错误;
故答案选:AC。
(5)T2K温度下,0-10min内,NO转化率为80%,则反应的NO物质的量为![]() ,则参与反应的CO物质的量为1.6mol
,则参与反应的CO物质的量为1.6mol![]() ;T1K温度下
;T1K温度下
则平衡常数K=![]() ,故答案为:0.08;1;
,故答案为:0.08;1;
(6)T1K温度下,向平衡后的容器内再加入2molN2和2molNO,则浓度商Q=![]() <1故平衡正移,故答案为:向右移动。
<1故平衡正移,故答案为:向右移动。


科目:高中化学 来源: 题型:
【题目】对烟道气中![]() 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。
I. ![]() 还原法
还原法

(1)一定条件下,由![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 的能量变化如图所示,每生成
的能量变化如图所示,每生成![]() ,该反应__________(填“放出”或“吸收”)的热量为____________。
,该反应__________(填“放出”或“吸收”)的热量为____________。
(2)在绝热恒容的密闭容器中,进行反应:![]() ,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量![]() ,平衡常数保持不变
,平衡常数保持不变
d.分离出![]() ,正、逆反应速率均保持不变
,正、逆反应速率均保持不变
(3)向![]() 恒温恒容密闭容器中通入
恒温恒容密闭容器中通入![]()
![]() 和
和![]()
![]() ,分别进行
,分别进行![]() 三组实验。在不同条件下发生反应:
三组实验。在不同条件下发生反应:![]() ,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是
,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是![]() ______
______![]() ______
______![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”);实验
”);实验![]() 从反应开始至平衡时,反应速率
从反应开始至平衡时,反应速率![]() ______________。
______________。

II.![]() 溶液吸收法
溶液吸收法
常温下,用![]() 溶液吸收
溶液吸收![]() 的过程中,溶液
的过程中,溶液![]() 随吸收
随吸收![]() 物质的量的变化曲线如图所示。
物质的量的变化曲线如图所示。

(4)常温下,![]() 的二级电离平衡常数
的二级电离平衡常数![]() 的数值为_________________。
的数值为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是

A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:

已知:①CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚(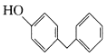 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
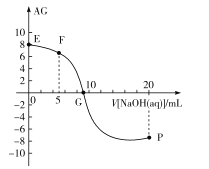
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出下列物质的分子式:含6个碳原子的链状单烯烃__________________________。
(2)在戊烷的各种同分异构体中,一氯代物种类最多的键线式是_________________。
(3)用系统命名法命名 :______________
:______________
(4)某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个-CH3、两个-CH2-、一个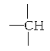 和一个-Cl。它的可能的结构有______________种
和一个-Cl。它的可能的结构有______________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)___________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越__________。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________________(可用分数表示)。
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com