
【题目】对烟道气中![]() 进行回收再利用具有较高的社会价值和经济价值。
进行回收再利用具有较高的社会价值和经济价值。
I. ![]() 还原法
还原法

(1)一定条件下,由![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 的能量变化如图所示,每生成
的能量变化如图所示,每生成![]() ,该反应__________(填“放出”或“吸收”)的热量为____________。
,该反应__________(填“放出”或“吸收”)的热量为____________。
(2)在绝热恒容的密闭容器中,进行反应:![]() ,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
,该反应的平衡常数表达式为_______________________,对此反应下列说法正确的是_________。
a.若混合气体密度保持不变,则已达平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量![]() ,平衡常数保持不变
,平衡常数保持不变
d.分离出![]() ,正、逆反应速率均保持不变
,正、逆反应速率均保持不变
(3)向![]() 恒温恒容密闭容器中通入
恒温恒容密闭容器中通入![]()
![]() 和
和![]()
![]() ,分别进行
,分别进行![]() 三组实验。在不同条件下发生反应:
三组实验。在不同条件下发生反应:![]() ,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是
,反应体系总压强随时间的变化曲线如图所示,则三组实验温度的大小关系是![]() ______
______![]() ______
______![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”);实验
”);实验![]() 从反应开始至平衡时,反应速率
从反应开始至平衡时,反应速率![]() ______________。
______________。

II.![]() 溶液吸收法
溶液吸收法
常温下,用![]() 溶液吸收
溶液吸收![]() 的过程中,溶液
的过程中,溶液![]() 随吸收
随吸收![]() 物质的量的变化曲线如图所示。
物质的量的变化曲线如图所示。

(4)常温下,![]() 的二级电离平衡常数
的二级电离平衡常数![]() 的数值为_________________。
的数值为_________________。
【答案】放出 135kJ K=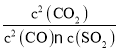 ad = < 6.25×10-3mol/(Lmin); 10-7.3
ad = < 6.25×10-3mol/(Lmin); 10-7.3
【解析】
(1)根据图象分析,反应物总能量高于生成物总能量,则反应为放热反应,正、逆反应活化能之差为反应放出的热量;
(2)气相为主的反应中,固体物质的浓度不变,根据平衡常数含义列出平衡常数表达式,结合常用判断化学平衡的方法判断化学反应是否达到平衡,据此逐项分析;
(3)反应为放热反应,反应前后气体物质的量减小,体系压强减小,体系a和体系b反应起始时和平衡时的压强都相等,则二者平衡常数相同,对于一定质量的气体来说,![]() 等于衡量,据此分析b和c的体系温度高低,根据化学反应速率定义计算SO2的平均反应速率;
等于衡量,据此分析b和c的体系温度高低,根据化学反应速率定义计算SO2的平均反应速率;
(4)H2SO3的一级电离平衡为:H2SO3![]() H++HSO3-,二级电离平衡为:HSO3-
H++HSO3-,二级电离平衡为:HSO3-![]() H++SO32-,根据Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线计算H2SO3的二级电离平衡常数。
H++SO32-,根据Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线计算H2SO3的二级电离平衡常数。
(1)根据图象分析,反应物的总能量比生成物总能量高,反应发生时多余的能量会释放出来,因此该反应的正反应为放热反应,正、逆反应的活化能之差为反应放出的热量,活化能的差值为270kJ/mol,由于反应产生的S质量为16g,其物质的量为16g÷32g/mol=0.5mol,所以反应放出的热量为:270kJ/mol×0.5mol=135kJ;
(2)根据平衡常数的含义,可知该反应的平衡常数表达式为K= 。
。
a.混合气体密度为ρ=![]() ,恒容容器容积V不变,反应前后气体的质量发生改变,则当反应到达平衡时,气体总质量m不变,因此若混合气体密度不变,说明反应已经达到平衡状态,a正确;
,恒容容器容积V不变,反应前后气体的质量发生改变,则当反应到达平衡时,气体总质量m不变,因此若混合气体密度不变,说明反应已经达到平衡状态,a正确;
b.反应达到平衡前后,气体总物质的量发生改变,体系压强改变,b错误;
c.达平衡后若再充入一定量CO2,使化学平衡逆向移动,由于反应在绝热容器中进行,反应逆向移动会产生热量变化,导致体系温度发生改变,化学平衡常数改变,c错误;
d.分离出S,由于S是固体,浓度不变,因此改变其物质的量,不影响化学平衡,因此正、逆反应速率均保持不变,d正确;
故合理选项是ad;
(3)体系a和体系b反应起始时和平衡时的压强都相等,则二者平衡常数相同,体系a和体系b的温度相等,根据![]() 等于衡量,可知初始时刻压强c>b,则实验温度c>b,因此三组实验温度的关系是a=b<c;实验a从反应开始至平衡时,压强由160kPa改变至120kPa,设反应过程转化了xmolSO2,由
等于衡量,可知初始时刻压强c>b,则实验温度c>b,因此三组实验温度的关系是a=b<c;实验a从反应开始至平衡时,压强由160kPa改变至120kPa,设反应过程转化了xmolSO2,由![]() 等于衡量可知,气体的压强与气体的体积(即总物质的量)成正比,所以有
等于衡量可知,气体的压强与气体的体积(即总物质的量)成正比,所以有![]() ,,解得x=0.75mol,则反应速率v(SO2)=
,,解得x=0.75mol,则反应速率v(SO2)=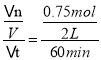 =6.25×10-3mol/(Lmin);
=6.25×10-3mol/(Lmin);
(4)H2SO3的一级电离平衡为:H2SO3![]() H++HSO3-,二级电离平衡为:HSO3-
H++HSO3-,二级电离平衡为:HSO3-![]() H++SO32-,根据Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线分析,H2SO3的二级电离平衡和SO32-的一级水解平衡相关,未通入SO2时,Na2SO3溶液的pH为10.6,则溶液中c(OH-)=10-3.4mol/L,忽略SO32-的二级水解,则溶液中c(HSO3-)=c(OH-)=10-3.4mol/L
H++SO32-,根据Na2SO3溶液吸收SO2的过程中,溶液pH随吸收SO2物质的量的变化曲线分析,H2SO3的二级电离平衡和SO32-的一级水解平衡相关,未通入SO2时,Na2SO3溶液的pH为10.6,则溶液中c(OH-)=10-3.4mol/L,忽略SO32-的二级水解,则溶液中c(HSO3-)=c(OH-)=10-3.4mol/L =10-6.7,H2SO3的二级电离平衡常数Ka2=
=10-6.7,H2SO3的二级电离平衡常数Ka2=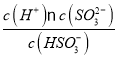 =
=![]() =10-7.3。
=10-7.3。


科目:高中化学 来源: 题型:
【题目】铁电池是一种新兴的化学电源,总反应方程式:3Zn+2FeO42﹣+8H2O=3Zn(OH)2↓+2Fe(OH)3↓+4OH﹣,其工作示意图如下。下列说法不正确的是( )

A. Zn 极上发生氧化反应
B. 电解质溶液中电子由左侧向右侧转移
C. 正极的电极反应式:FeO42﹣+3e﹣+4H2O=Fe(OH)3+5OH﹣
D. 反应一段时间后,Zn 极质量减少 6.5g,假设反应前后溶液体积不变仍为 100 mL,则 OH﹣浓度约增大了 1.33 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值。下列叙述正确的是
为阿伏加德罗常数的数值。下列叙述正确的是
A. 标准状况下,22.4L![]() 含有分子数目
含有分子数目![]()
B. 25℃,1L pH = 13的![]() 数目为0.2
数目为0.2![]()
C. 在足量![]() 中0.1mol Fe燃烧完全,转移电子数目为0.3
中0.1mol Fe燃烧完全,转移电子数目为0.3![]()
D. 密闭容器中3 mol ![]() 与1 mol
与1 mol![]() 充分反应可生成
充分反应可生成![]() 分子数目为
分子数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】品牌膨松剂中发挥作用的物质为碳酸氢钠。某化学兴趣小组利用下列有关装置,加热该膨松剂样品,通过放出气体的量来检验其品质。

(1)装置D仪器的名称是_________。
(2)装置E中所盛试剂为____________,其作用是______________。
(3)装置的连接顺序为_____________(填装置序号)。
(4)实验过程中,装置A中发生反应的化学方程式为________________。
(5)实验过程中必须向装置内通入空气,装置C的作用是除去空气中的________(填化学式)。加热前,通入一段时间空气的具体操作为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾可做净水剂的原因:_______________________________________________(请用相关的化学用语和文字描述),若向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是_________________________,有关的离子方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)在100℃下,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为______________。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积约为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)性能优越,钛被称为“第三金属”(铁、铝分为第一、二金属),工业以TiO2冶炼Ti的主要反应有:①TiO2+2C+2Cl2![]() TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg![]() 2MgCl2+Ti下列叙述正确的是( )
2MgCl2+Ti下列叙述正确的是( )
A. 反应①是置换反应 B. 反应②是复分解反应
C. 反应①中TiO2是氧化剂 D. 反应②中金属镁是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素均不是稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )

A. 原子半径:W>Z
B. 气态氢化物的稳定性:W>X
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是
A. 将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液
B. 将少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液
C. 将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2(g)
D. 将少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入过量NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com