
【题目】酸碱中和滴定原理也用在其他物质滴定,例如:下面是某化学学习小组的同学对草酸晶体进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值通过查阅资料知得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取2.52 g纯草酸晶体,将其配制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。问:
(1)通过上述数据,计算x=_____________。
(2)滴定终点时俯视滴定管刻度,则由此测得的x值会_______(填“偏大”、“偏小”或“不变”)
【答案】2 偏大
【解析】
(1)根据二者恰好反应时物质的量关系,由KMnO4的物质的量计算草酸晶体的物质的量,结合晶体的质量可知H2C2O4晶体中结晶水x的值;
(2)若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大、x偏大。
(1)KMnO4与草酸发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,25.00 mL、0.1000 mol·L-1的KMnO4的物质的量为n(KMnO4)=c·V=0.1000 mol/L×0.020 L=2.0×10-3 mol,则2.52 g纯草酸晶体中含H2C2O4的物质的量n(H2C2O4)=![]() n(KMnO4)
n(KMnO4)![]() ×=
×=![]() ×2.0×10-3 mol×
×2.0×10-3 mol×![]() =2.0×10-2 mol,则2.52 g H2C2O4xH2O中含H2O的物质的量为(2.52 g-0.0200 mol×90 g/mol)÷18 g/mol=0.040 0 mol,则x=2;
=2.0×10-2 mol,则2.52 g H2C2O4xH2O中含H2O的物质的量为(2.52 g-0.0200 mol×90 g/mol)÷18 g/mol=0.040 0 mol,则x=2;
(2)若滴定终点时俯视滴定管刻度读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大、x偏大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上CO2、CH4等含碳化合物有着重要的应用。
(1)科学家以CH4为原料来制备乙烯,同时得到氢气。已知相关物质的标准燃烧热如下表所示,写出甲烷制备乙烯的热化学方程式:__。
物质 | 标准燃烧热/kJ·mol-1 |
氢气 | -285.8 |
甲烷 | -890.3 |
乙烯 | -1411.0 |
(2)在400℃时,向初始体积为1L的恒容密闭反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%。
①该温度下,平衡常数K=__。
②若向该平衡体系中充入等物质的量的CH4和H2,则平衡将___(填“正向移动”或“逆向移动”或“不移动”成“无法确定”),理由是__。
(3)科学家用氮化镓材料与铜组装成如图所示的人工光合系统实现CO2的再利用。
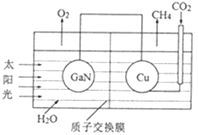
①该电化学装置属于__(填“原电池”或“电解池”)。
②该电池的Cu电极上发生反应的电极方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I.已知:①N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
②CO的燃烧热△H=-283 kJ·mol-1。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为________________________________。
(2)一定温度下,在恒容密闭容器中充入1 mol NO和2 mol CO进行该反应,下列不能判断反应达到化学平衡状态的是___________(用序号填空)
①单位时间内消耗a mol CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
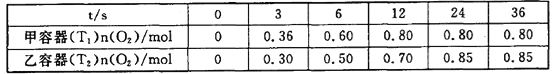
(3)T1______T2(填>、<或=,下同),该反应△H________0。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=________。
(5)甲容器中NO2平衡转化率为__________,T1时该反应的平衡常数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中氮是造成水体富营养化的主要原因。若某污水中NH4Cl含量为180mg/L。
(1)写出NH4Cl电子式:___。
(2)氮原子的电子排布式是:___,写出与氯同周期,有2个未成对电子的原子的元素符号为___、___。
(3)为除去废水中的NH4+,向103L该污水中加入0.1mo1/LNaOH溶液,理论上需要NaOH溶液的体积为___L(计算结果保留两位小数)。
(4)可先在酸性污水中加入铁屑将NO3-转化为NH4+后再除去,请配平下列离子方程式并标出电子转移的方向和数目___。
___Fe+___NO3-+___H+→___Fe2++___NH4++___H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于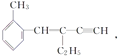 ,下列结论正确的是( )
,下列结论正确的是( )
A. 该有机物分子式为C13H16 B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线 D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
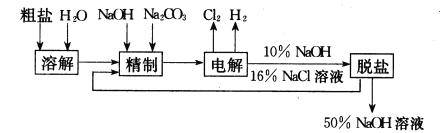
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应式为__________。 与电源负极相连的电极附近,溶液pH ________(选填:不变,升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________,
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 _________。
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、_________(填写操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
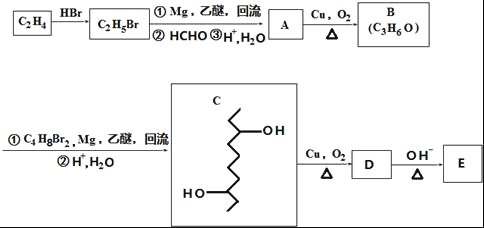
【题目】有机物E的合成路线如图:
已知:
①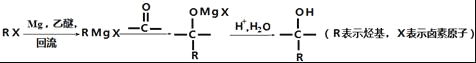
②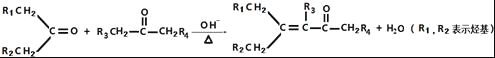
完成下列填空:
(1)B中官能团的名称为_____.C2H4生成C2H5Br的反应类型为____.
(2)C的分子式为_____.
(3)检验C2H5Br分子中含有溴原子的实验方案为____.
(4)E的结构简式为![]() ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
(5)写出一种满足下列条件的有机物的结构简式_____
①分子式只比E少2个氢原子
②与FeCl3发生显色反应
③分子中含有4种不同化学环境的氢原子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com