
【题目】生活污水中氮是造成水体富营养化的主要原因。若某污水中NH4Cl含量为180mg/L。
(1)写出NH4Cl电子式:___。
(2)氮原子的电子排布式是:___,写出与氯同周期,有2个未成对电子的原子的元素符号为___、___。
(3)为除去废水中的NH4+,向103L该污水中加入0.1mo1/LNaOH溶液,理论上需要NaOH溶液的体积为___L(计算结果保留两位小数)。
(4)可先在酸性污水中加入铁屑将NO3-转化为NH4+后再除去,请配平下列离子方程式并标出电子转移的方向和数目___。
___Fe+___NO3-+___H+→___Fe2++___NH4++___H2O
【答案】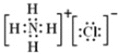 Si S 1s22s22p3 33.64
Si S 1s22s22p3 33.64 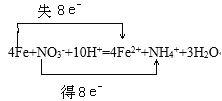 4 1 10 4 1 3
4 1 10 4 1 3
【解析】
(1)NH4Cl是离子化合物;
(2)氮为7号元素;氯原子的核外电子排布式为1s22s22p63s23p5;
(3)根据NH4+和NaOH溶液的反应计算需要NaOH溶液的体积为;
(4)根据氧化还原反应,配平离子方程式并标出电子转移的方向和数目。
(1)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: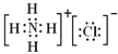 ;
;
(2)氮原子电子排布式是:1s22s22p3;氯原子的核外电子排布式为1s22s22p63s23p5,有一个未成对的电子,与其同周期且有2个未成对电子的原子的的核外电子排布式为1s22s22p63s23p4和1s22s22p63s23p2,元素符号为S、Si;
(3) 某污水中NH4Cl含量为180mg/L,103L污水中含有180mg/L×103L =180000mg=180gNH4Cl,NH4Cl的物质的量为![]() ≈3.364mol,NH4+的物质的量也是3.364mol,为除去废水中的NH4+,向该污水中加入0.1mo1/LNaOH溶液,理论上需要NaOH的物质的量为3.364mol,则所需NaOH溶液的体积为
≈3.364mol,NH4+的物质的量也是3.364mol,为除去废水中的NH4+,向该污水中加入0.1mo1/LNaOH溶液,理论上需要NaOH的物质的量为3.364mol,则所需NaOH溶液的体积为![]() =33.64L;
=33.64L;
(4)该反应中铁元素的化合价由0价升高至+2价,氮元素的化合价由+5价降低至-3价,由化合价升降守恒和质量守恒可以配平该离子方程式并标出电子转移的方向和数目如下: 。
。


科目:高中化学 来源: 题型:
【题目】烟气脱硝技术是烟气治理的发展方向和研究热点。
(1)用NH3选择性脱除氮氧化物,有如下反应:
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
已知化学键的键能数据如下表:
化学键 | NO中的氮氧键 | N-H | N | O-H |
键能(kJ·mol-1) | a | b | c | d |
则该反应的ΔH=__kJ·mol-1。
(2)在汽车尾气的净化装置中CO和NO发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
实验测得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)
①达平衡后,仅升高温度,k正增大的倍数__k逆增大的倍数(填“>”或“<”或“=”)。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡,CO的转化率为50%,则![]() =__。
=__。
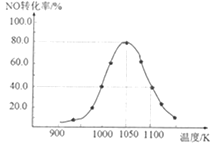
(3)现利用反应除去汽车尾气中的NOx:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密闭容器中发生该反应,催化反应相同时间,测得不同温度下NO的转化率a(NO)随温度的变化如图所示。由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是__。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
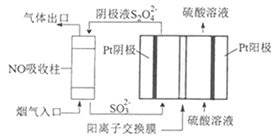
①阴极区的电极反应式为__。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子吸引电子的能力大小可用一定数值X表示,X值越大,其原子吸引电子的能力越强,在所形成的化合物中为带负电荷的一方。下表是某些元素的X值:
元素符号 |
|
|
|
|
|
|
X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
元素符号 |
|
|
|
|
|
|
X值 | 0.93 | 1.60 | 1.90 | 2.19 | 2.55 | 3.16 |
(1)通过分析X值的变化规律,确定![]() 、
、![]() 的X值范围:______
的X值范围:______![]() ______;______
______;______![]() ______。
______。
(2)推测X值与原子半径的关系为______。
(3)某有机化合物的结构为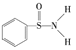 ,其中
,其中![]() 键中,你认为共用电子对偏向______(填元素符号)。
键中,你认为共用电子对偏向______(填元素符号)。
(4)如果X值为电负性的数值,试推断![]() 中化学键的类型为______。
中化学键的类型为______。
(5)预测元素周期表中X值最小的元素(放射性元素除外)是______(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2B溶液中滴加0.2mol·L-1NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ表示H2B,Ⅱ代表HB-、Ⅲ代表B2-),根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是
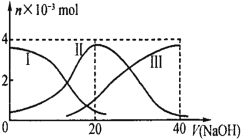
A. c(Na+)>c(HB-)>c(H+)>c(B2-)>c(H2B)
B. c(Na+)>c(HB-)>c(OH-)>c(H2B)>c(H+)>c(B2-)
C. c(Na+)>c(H+)>c(HB-)>c(B2-)>c(OH-)>c(H2B)
D. c(Na+)>c(OH-)>c(HB-)>c(H2B)>c(H+)>c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱中和滴定原理也用在其他物质滴定,例如:下面是某化学学习小组的同学对草酸晶体进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值通过查阅资料知得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取2.52 g纯草酸晶体,将其配制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。问:
(1)通过上述数据,计算x=_____________。
(2)滴定终点时俯视滴定管刻度,则由此测得的x值会_______(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+* H)。下列说法错误的是
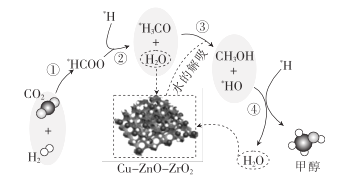
A.向该反应体系中加入少量的水能增加甲醇的收率
B.带*标记的物质是该反应历程中的中间产物
C.二氧化碳加氢制甲醇的过程中原子利用率达100%
D.第③步的反应式为*H3CO+ H2O→CH3OH+*HO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.在醋酸溶液的![]() ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的![]() ,则
,则![]()
B.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的![]()
C.![]() 盐酸的
盐酸的![]() ,
,![]() 盐酸的
盐酸的![]()
D.若1mL![]() 的盐酸与100mL
的盐酸与100mL![]() 溶液混合后,溶液的
溶液混合后,溶液的![]() 则
则![]() 溶液的
溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知NH3H2O与醋酸的电离度在同温同浓度下相等。向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。
甲同学的解释是:
Mg(OH)2 (固)![]() Mg2++2OH- (1)
Mg2++2OH- (1)
NH4++H2O![]() NH3H2O+H+ (2)
NH3H2O+H+ (2)
H++OH-![]() H2O (3)
H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2 (固)![]() Mg2++2OH- (1)
Mg2++2OH- (1)
NH4Cl=NH4++Cl- (2)
NH4++OH-![]() NH3H2O (3)
NH3H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确。
(1)他选用的试剂是__________(填写编号)。
A. NH4NO3 B. CH3COONH4 C. Na2CO3 D. NH3H2O
(2)实验步骤:____________________________;
(3)实验结论:____________________________。
Ⅱ.关于“电解氯化铜溶液时的pH变化”问题,化学界有两种不同的观点。
观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高;
观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时的pH的变化如图。请回答下列问题:
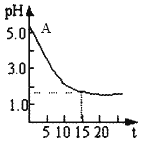
(1)用离子方程式表示电解前氯化铜溶液的pH处于A点的原因:______________。
(2)“理论派”所持观点的理论依据是:_______________________。
(3)你支持哪种观点:_________(理论派、实验派)。其理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A. 绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应
B. 五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
C. 三聚氰胺分子结构如图所示 ,分子式是C3H6N6
,分子式是C3H6N6
D. 氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com