
【题目】不同元素的原子吸引电子的能力大小可用一定数值X表示,X值越大,其原子吸引电子的能力越强,在所形成的化合物中为带负电荷的一方。下表是某些元素的X值:
元素符号 |
|
|
|
|
|
|
X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
元素符号 |
|
|
|
|
|
|
X值 | 0.93 | 1.60 | 1.90 | 2.19 | 2.55 | 3.16 |
(1)通过分析X值的变化规律,确定![]() 、
、![]() 的X值范围:______
的X值范围:______![]() ______;______
______;______![]() ______。
______。
(2)推测X值与原子半径的关系为______。
(3)某有机化合物的结构为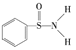 ,其中
,其中![]() 键中,你认为共用电子对偏向______(填元素符号)。
键中,你认为共用电子对偏向______(填元素符号)。
(4)如果X值为电负性的数值,试推断![]() 中化学键的类型为______。
中化学键的类型为______。
(5)预测元素周期表中X值最小的元素(放射性元素除外)是______(填元素符号)。
【答案】0.93 1.57 2.55 3.44 原子半径越大,X值越小 N 共价键 Cs
【解析】
(1)从表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,则同周期中x(Na)<x(Mg)<x(Al),同主族中x(Mg)<x(Be),综合可得:0.93<x(Mg)<1.57;同周期中x(C)<x(N)<x(O),可得2.53<x(N)<3.44;
(2)x值在周期表中的递变关系与原子半径的递变关系恰好相反,即:同周期从左到右,随着原子半径依次减小,X值依次增大;同主族从上到下,原子半径越大,X值越小;
(3)对比周期表中对角线位置的x值可知:x(B)>x(Si),x(C)>x(P),x(O)>x(Cl),则可推知:x(N)>x(S),故在S-N中,共有电子对应偏向N;
(4)查表知:AlCl3的△x=156<1.7,又x(Br)<x(Cl),所以AlBr3的△x应小于AlCl3的,因此AlBr3中的化学键为共价键;
(5)根据递变规律,x值最小的应位于第六周期ⅠA族,即为Cs。


科目:高中化学 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常温下0.1 mol/L氨水(pH=11)的说法正确的是
A.该氨水显弱碱性
B.加水稀释过程中,![]() 的值减小
的值减小
C.与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+)
D.加入少量NH4Cl 固体,溶液中水的电离平衡:H2O![]() H+ + OH―向右移动
H+ + OH―向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种有机化合物的结构简式:(选填序号,下同)
①CH3CH═CH﹣CH2CH3 ② ③CH3CH2﹣CH2﹣CH2OH ④CH3﹣C≡C﹣CH3 ⑤CH3﹣CH2﹣C≡CH ⑥
③CH3CH2﹣CH2﹣CH2OH ④CH3﹣C≡C﹣CH3 ⑤CH3﹣CH2﹣C≡CH ⑥![]()
⑦CH3CH2CH2OCH3 ⑧![]() ⑨CH2═CH﹣CH═CH2 ⑩CH2═CH﹣CH2CH2CH3
⑨CH2═CH﹣CH═CH2 ⑩CH2═CH﹣CH2CH2CH3
(1)互为同分异构体的是______________ (2)互为同系物的是___________
(3)官能团位置不同的同分异构体是_______ (4)官能团类型不同的同分异构体是__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中氮是造成水体富营养化的主要原因。若某污水中NH4Cl含量为180mg/L。
(1)写出NH4Cl电子式:___。
(2)氮原子的电子排布式是:___,写出与氯同周期,有2个未成对电子的原子的元素符号为___、___。
(3)为除去废水中的NH4+,向103L该污水中加入0.1mo1/LNaOH溶液,理论上需要NaOH溶液的体积为___L(计算结果保留两位小数)。
(4)可先在酸性污水中加入铁屑将NO3-转化为NH4+后再除去,请配平下列离子方程式并标出电子转移的方向和数目___。
___Fe+___NO3-+___H+→___Fe2++___NH4++___H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是 (填序号)。
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子都在同一条直线上,则A的结构简式为 。
(3)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1mol A最多可与1mol H2加成,则A的名称是 。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为 ;若其苯环上的一溴代物只有一种,则符合此条件的烃B有 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com