
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:
(ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
(ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是____________________________________________(以化学方程式表示)。
(2)分析二甲醚合成反应(ⅳ)对于CO转化率的影响
________________________________________________________________________。
(3)有研究者在催化剂(含CuZnAlO和Al2O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是_________________________________________________。
(4)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为__________
_____________________,一个二甲醚分子经过电化学氧化,可以产生________________个电子的电量;该电池的理论输出电压为1.20 V,能量密度E=_______________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: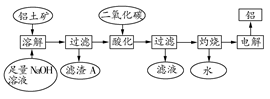
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式: 。
(2)滤渣A的主要成分为 ;滤渣A的用途是 (只写一种);实验室过滤时使用玻璃棒,其作用是 。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是 。
(4)若将铝溶解,下列试剂中最好选用 (填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
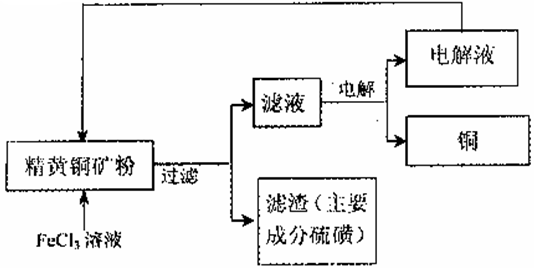
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺:将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为:2CuFeS2 + 2SiO2+5O2=2Cu+2FeSi03+4SO2该反应的氧化剂是_____。
(2)下列处理SO2的方法,不合理的是_____
| A.高空排放 |
| B.用纯碱溶液吸收制备亚硫酸钠 |
| C.用氨水吸收后,再经氧化制备硫酸铵 |
| D.用BaCl2溶液吸收制备BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下: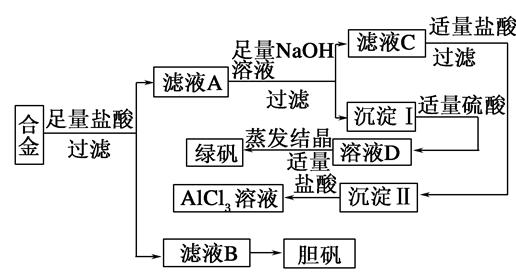
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理” 或“不合理”),理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3=FeCO3+Na2SO4
FeCO3+C6H8O7=FeC6H6O7+CO2+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图是传统的工业生产金属铝的基本流程图。
请回答:
(1)金属铝常用来制造容器,但铝制餐具不宜用来蒸煮或长时间存放酸性、碱性等食物,写出铝与氢氧化钠溶液反应的离子方程式:_____________________________________。
石油炼制和煤的干馏产品________(填物质名称)作电解铝的阴极和阳极材料。
(2)在冶炼过程中,阳极材料需要定期进行更换,原因是该极材料不断被消耗,产生这种现象的原因是____________________________________(用化学方程式表示)。
(3)工业上通过电解熔融的MgCl2制取金属镁,电解反应方程式为________________。镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物,请说明理由。________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯化铁是常见的水处理剂,无水FeCl3易升华。工业上制备无水FeCl3的一种工艺如图所示:
(1)加入吸收塔的吸收剂X应是 (填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5 mL饱和FeCl3溶液滴入50 mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为 。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入 且保持过量,然后进行的操作依次为 、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为 。
(5)铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+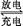 Fe2++Cr3+
Fe2++Cr3+
则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氟化铜是一种锂/氟化铜电池正极活性材料,可通过下列方法制备:在铂皿中将氧化铜用过量的40%氢氟酸溶解,先制成CuF2·5HF·5H2O,再将生成物放入镍管内的铂舟中,在干燥的氟化氢气流中以400%进行加热脱水,最后通入氮气。
(1)制备过程中用铂皿而不用玻璃器皿的原因是______________________________________(用化学方程式表示)。
(2) 锂/氟化铜电池放电时总反应为置换反应,其化学方程式为____________________________________________________。
(3)准备称取上述制备的样品(仅含CuF2和CuO) 2.120 g,在通风橱中加入稀硫酸至完全溶解,然后加入足量的氢氧化钠溶液,得沉淀,将沉淀充分灼烧,得1.680 g黑色固体,计算样品中CuF2和CuO的物质的量之比。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁和铁的化合物用途广泛。请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:_______________________。
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______________________________________。
(2)爱迪生蓄电池的反应式为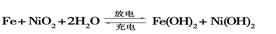
①爱迪生蓄电池的正极是 , 该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______。
②高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。写出在用电解法制取高铁酸钠时,阳极的电极反应式___________________________________。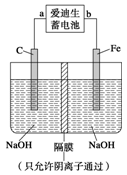
③你认为高铁酸钠作为一种新型净水剂的理由错误的是 ______。
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com