
【题目】刑法修正案(八)中明确规定2011年5月1日“醉驾入刑”。
(1)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下
①通过样品的质谱分析测得A的相对分子质量为60;
②经测定,有机物A的核磁共振氢谱示意图如图:

③对A的水溶液进行测定发现该溶液pH<7。根据以上分析,写出A的结构简式___________。
(2)工业酒精是含水约4%的液态乙醇。要在实验室中将工业酒精转化为无水酒精,请回答下列问题:
①下列做法中最不可取的是(填写代号)_ __________。
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
②在该方法的实验步骤里,紧挨加热之前的操作是___________,并且对此要注意的问题是______________________。
③用酒精灯作热源,在加热的过程中要适时调整酒精灯的上下或左右位置,目的是_______________。
【答案】CH3COOH C 向冷凝管内通冷却水 水要从下口进、上口出 使蒸馏烧瓶内的支管口处保持某一恒温
【解析】
(1)根据①可知有机物A的相对分子质量为60;根据②可知有机物A中含有两种类型的氢原子,且两类氢原子个数比为1:3;根据③可判断有机物A含有羧基(-COOH);
(2)将工业酒精转化为无水酒精,加CaO与水反应后增大与乙醇的沸点差异;结合蒸馏实验需要的仪器及加热后馏分需要冷却分析;加热的过程中要适时调整酒精灯的上下或左右位置,控制蒸馏需要的温度。
(1)核磁共振氢谱中有几个峰就有几中氢原子,图2有2个峰,说明有2种氢原子,溶液pH<7,呈酸性,说明含有羧基,根据相对分子质量为60,60-45=13,另一个基团为甲基,故答案为:CH3COOH;
(2)①将工业酒精转化为无水酒精,加CaO与水反应后增大与乙醇的沸点差异,然后蒸馏即可,或加入过量的生石灰后,氢氧化钙在乙醇中溶解度较小,过滤分离,所以最不可取的为C,故答案为:C;
②紧挨加热之前的操作是向冷凝管内通冷却水,此时要注意水要从下口进、上口出,故答案为:向冷凝管内通冷却水;水要从下口进、上口出;
③加热的过程中要适时调整酒精灯的上下或左右位置,控制蒸馏需要的温度,即操作的目的为使蒸馏烧瓶内的支管口处保持某一恒温,故答案为:使蒸馏烧瓶内的支管口处保持某一恒温。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:

已知:R1—CHO+R2—CH2CHO![]() CHOHR1CHCHOR2
CHOHR1CHCHOR2
请回答:
(1)C的化学名称为______________;M中含氧官能团的名称为____________。
(2)F→G的反应类型为__________;
检验产物G中新生成官能团的实验方法为______________________________。
(3)C→D的化学方程式为________________________________________。
(4)E的结构简式为_______________________;
H的顺式结构简式为_____________________________。
(5)同时满足下列条件的F的同分异构体有________种(不考虑立体异构);
①属于芳香族化合物 ②能发生水解反应和银镜反应
其中核磁共振氢谱有4种吸收峰的物质的结构简式为_________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:AG=lgc(H+)/c(OH-)。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL0.1mol/LMOH溶液,滴定曲线如下图所示。下列说法正确的是

A. 该流定过程可选择酚酞作为指示剂
B. 溶液中由水电离的c(H+):C点>D点
C. C点时加入盐酸溶液的体积等于10mL
D. 若B点加入的盐酸溶液体积为5mL,所得榕液中:c(M+)+c(H+)=c(MOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
(1)用铅精矿火法炼铅的反应的化学方程式为_________。
(2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为:____。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:① 不同温度下PbCl2的溶解度如下表所示。
温度/℃ | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
② PbCl2为能溶于水的弱电解质,在Cl—浓度较大的溶液中,存在平衡: PbCl2(aq)+2Cl—(aq) ![]() PbCl42—(aq)
PbCl42—(aq)
(3)浸取液中FeCl3的作用是_________。
(4)结合信息判断,操作a为_________,以利于PbCl2的析出。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。
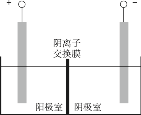
① 溶液3应置于______(填“阴极室”或“阳极室”)中。
② 简述滤液2电解后再生为FeCl3的可能原理:______。
③ 若铅精矿的质量为a g,铅浸出率为b,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机物中碳和氢的质量分数,常用的方法是燃烧分析法,用氧化铜作催化剂,在750 ℃左右使有机物在氧气流中全部氧化成CO2和H2O,分别用装有固体NaOH和固体Mg(ClO4)2(高氯酸镁)的吸收管吸收CO2和H2O。某课外活动小组,设计用下列装置制取乙烯,并测定乙烯分子中碳、氢原子个数比,甲为燃烧管,当乙烯和氧气通过时,由于催化剂的存在而不会发生爆炸,乙烯将被氧化成CO2和H2O。
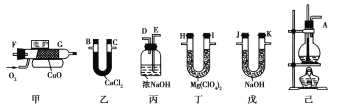
请回答下列问题:
(1)整套装置的连接顺序(按从左到右顺序用字母填写): ____接____,____接____,____接____,____接____,____接___.
(2)烧瓶中的试剂是浓H2SO4和酒精,其中浓H2SO4的作用是___________,在烧瓶中还要加少量碎瓷片,其作用是__________。
(3)实验时应使烧瓶中溶液温度迅速升至170 ℃,原因是____________________。实验结束时,烧瓶中有黑色物质生成,其原因是__________。
(4)乙、丙装置的作用分别是:乙:____________________;丙:_____________________。
(5)若实验前后,丁增重a g,戊增重b g,则测得乙烯分子中C、H原子个数比为__________。
(6)若测得C/H值偏高,导致这种误差的可能原因是(_____)
A.乙烯中混有少量乙醚(C2H5OC2H5)
B.乙烯进入燃烧管时,仍含有少量水蒸气
C.乙烯中混有少量CO
D.乙烯进入燃烧管时,仍含有少量CO2
(7)若仍用上述装置测定某烃A的化学式,经测定丁增重4.5 g,戊增重8.8 g,则A的最简式为__________;若要确定A的化学式,是否还需要其他数据(若需要,说明还需测定哪些数据;若不需要,说明其原因)?_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是

A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量HCl溶液的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】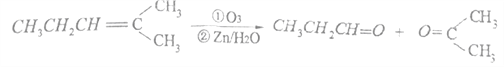
上述反应可用来推断烯烃的结构,某单烯烃A可以发生如下图示的转化,回答下列问题
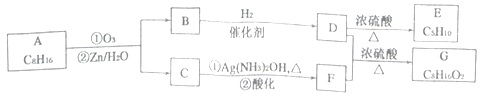
(1)B的分子式为_____________,D中含有官能团的名称________________。
(2)C→F中步骤①的化学反应方程式______________,该反应的反应类型是___________。
(3)B无银镜反应,D在浓硫酸存在下加热可得到能使溴水褪色且只有一种结构的物质E(不考虑立体异构),则A的结构简式为________________。
(4)G的同分异构体中,满足下列要求的结构有__________种(不考虑立体异构)。
①属于酯类;②酸性条件下水解能得到相对分子质量为74的有机物
(5)已知: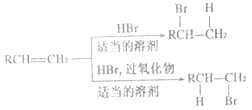 ,请写出由C制备2—丙醇的合成路线_________________。
,请写出由C制备2—丙醇的合成路线_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。
。![]() 时,向
时,向![]() 溶液中滴加氢氧化钠溶液,混合溶液的pOH与
溶液中滴加氢氧化钠溶液,混合溶液的pOH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.M点溶液中:![]()
B.![]() 的数量级为
的数量级为![]()
C.M点到N点: 的值不变
的值不变
D.N点:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com