
【题目】下列各表中的数字代表的时原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
A.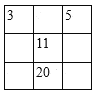 B.
B.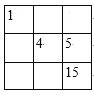
C.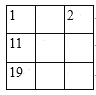 D.
D.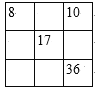
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是( )

A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应和酯化反应
D. 1 mol迷迭香酸最多能和5 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刑法修正案(八)中明确规定2011年5月1日“醉驾入刑”。
(1)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下
①通过样品的质谱分析测得A的相对分子质量为60;
②经测定,有机物A的核磁共振氢谱示意图如图:

③对A的水溶液进行测定发现该溶液pH<7。根据以上分析,写出A的结构简式___________。
(2)工业酒精是含水约4%的液态乙醇。要在实验室中将工业酒精转化为无水酒精,请回答下列问题:
①下列做法中最不可取的是(填写代号)_ __________。
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
②在该方法的实验步骤里,紧挨加热之前的操作是___________,并且对此要注意的问题是______________________。
③用酒精灯作热源,在加热的过程中要适时调整酒精灯的上下或左右位置,目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的命名是否正确?若不正确,请在错误命名下边写出正确名称。
A.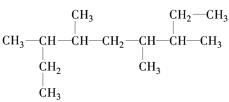 3,5-二甲基-2,6-二乙基庚烷___________________
3,5-二甲基-2,6-二乙基庚烷___________________
B.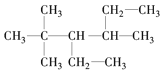 3,5,5-三甲基-4-乙基庚烷____________________
3,5,5-三甲基-4-乙基庚烷____________________
C.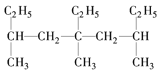 5-乙基-3,5,7-三甲基壬烷_____________________
5-乙基-3,5,7-三甲基壬烷_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂。利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在_____________中溶解,完全溶解后,全部转移至100 mL的_____________中,加蒸馏水至_______________。
②滴定:取0.00950 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-=S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液_____________________________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_______%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业用黄铜矿(主要成分CuFeS2,含少量锌、铅的硫化物)冶炼铜的一种方法如下:
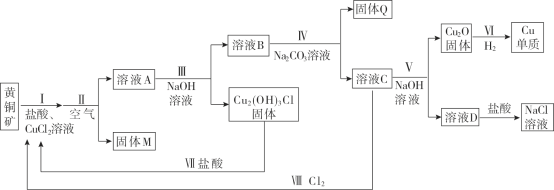
(1)Ⅰ中发生下列反应。ⅰ.CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2Sⅱ. CuCl + Cl-![]() CuCl2-,I中盐酸的作用是________。
CuCl2-,I中盐酸的作用是________。
(2)Ⅱ中通入空气,将Fe2+转化FeOOH沉淀。
①Fe2+转化为FeOOH的离子方程式是__________。
②溶液A中含金属元素的离子有:Zn2+、Pb2+和________。
(3)Ⅲ中需控制NaOH溶液的用量,其原因是________。
(4)Ⅳ中加入Na2CO3溶液的目的是________。
(5)V中反应的离子方程式是________。
(6)从物质循环利用的角度分析,如何处理NaCl溶液才能更好地服务于该冶炼铜的工艺,并说明理由:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )

A.因为两种酸溶液的pH相等,故V1一定等于V2
B.若V1>V2,则说明HA为强酸,HB为弱酸
C.若实验①中,V=V1,则混合液中c(Na+)=c(A-)
D.实验②的混合溶液,可能有pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.苯和浓硫酸在70~80℃时发生磺化反应
B.芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质
C.甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应
D.等质量的烃(CxHy)耗氧量取决于y/x的值,越小则耗氧越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离会减小环境污染,同时制得ZnSO4·7H2O实现资源的再利用,其流程图如下。已知FeAsO4难溶于水和酸;ZnSO4·7H2O易溶于水,难溶于酒精。
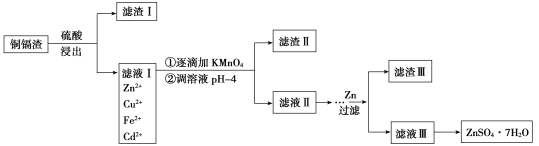
常温下金属离子沉淀的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出速率可以采用的方法是(写出其中一点即可)________。
(2)滤液Ⅰ中有少量AsO33—,若不除去,则AsO33—与Cd反应会产生一种有毒氢化物气体,其分子式为____,向滤液Ⅰ中逐滴滴入酸性KMnO4溶液可与AsO33—反应生成FeAsO4,完成并配平下列反应的离子方程式___:Fe2++AsO33—+MnO4—+___=FeAsO4↓+Mn2++__,判断该滴定终点的现象是__________。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的成分为________。
(4)常温下Zn(OH)2的溶度积Ksp=________。
(5)制得的ZnSO4·7H2O需洗涤,洗涤晶体时可选用试剂为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com