
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离会减小环境污染,同时制得ZnSO4·7H2O实现资源的再利用,其流程图如下。已知FeAsO4难溶于水和酸;ZnSO4·7H2O易溶于水,难溶于酒精。
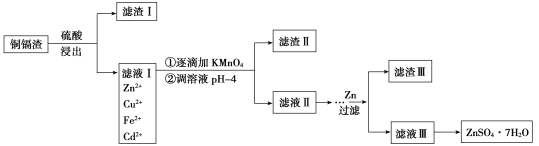
常温下金属离子沉淀的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出速率可以采用的方法是(写出其中一点即可)________。
(2)滤液Ⅰ中有少量AsO33—,若不除去,则AsO33—与Cd反应会产生一种有毒氢化物气体,其分子式为____,向滤液Ⅰ中逐滴滴入酸性KMnO4溶液可与AsO33—反应生成FeAsO4,完成并配平下列反应的离子方程式___:Fe2++AsO33—+MnO4—+___=FeAsO4↓+Mn2++__,判断该滴定终点的现象是__________。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的成分为________。
(4)常温下Zn(OH)2的溶度积Ksp=________。
(5)制得的ZnSO4·7H2O需洗涤,洗涤晶体时可选用试剂为________。
【答案】增大硫酸浓度、升高溶液温度、搅拌、将铜镉渣磨碎成小颗粒等合理答案均可 AsH3 14H++5Fe2++5AsO33—+3MnO4-=5FeAsO4↓+3Mn2++7H2O 滴最后一滴高锰酸钾,溶液变为浅紫色(或紫色或紫红色或粉红色)且半分钟内不恢复为原色,则反应到终点 Zn、ZnO、ZnCO3、Zn(OH)2等合理答案均可 FeAsO4、Fe(OH)3 1×10-17 乙醇或饱和硫酸锌溶液
【解析】
炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少,加入硫酸浸出过滤得到滤渣Ⅰ和滤液Ⅰ主要含Zn2+、Cu2+、Fe2+、Cd2+离子,添加高锰酸钾溶液氧化亚铁离子为铁离子,氧化AsO33-生成FeAsO4沉淀,调节溶液pH沉淀铁离子,过滤得到滤渣Ⅱ为FeAsO4和Fe(OH)3,滤液Ⅱ中主要为锌离子和镉离子,加入足量锌反应后过滤,得到滤液Ⅲ为硫酸锌溶液,蒸发浓缩、冷却结晶、过滤洗涤、干燥得到硫酸锌晶体,以此解答该题。
(1)可以通过适当增大硫酸浓度、升高溶液温度、搅拌、将铜镉渣磨碎成小颗粒等措施提高浸出率;
(2)AsO33-与Cd反应,Cd被氧化,则AsO33-被还原为一种有毒氢化物气体,此气体的分子式为AsH3;向滤液Ⅰ中逐滴滴入酸性KMnO4溶液可与AsO33-发生反应生成FeAsO4,根据电子守恒、电荷守恒及原子守恒得此反应的离子方程式为5Fe2++5AsO33-+3MnO4-+14H+=3Mn2++5FeAsO4↓+7H2O;当滴最后一滴高锰酸钾,溶液变为粉红色且半分钟内不恢复为原色,则反应到终点;
(3)流程中②调节pH时,选用的试剂要能与H+反应,同时不引入新的杂质,则可选用的试剂为ZnO、ZnCO3或Zn(OH)2;由图示可知,当溶液pH=4时,溶液中的Fe3+水解完全转化为Fe(OH)3,则滤渣Ⅱ的主要成分为FeAsO4、Fe(OH)3;
(4)沉淀完全时溶液pH=8,即c(OH-)=1×10-6 mol/L,此时溶液中c(Zn2+)浓度为1×10-5 mol/L,常温下Zn(OH)2的溶度积Ksp=c(Zn2+)×c2(OH-)=1×10-17;
(5)因ZnSO4·7H2O易溶于水,难溶于酒精,制得的ZnSO4·7H2O晶体可选择酒精或饱和硫酸锌溶液洗涤。


科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。
。![]() 时,向
时,向![]() 溶液中滴加氢氧化钠溶液,混合溶液的pOH与
溶液中滴加氢氧化钠溶液,混合溶液的pOH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A.M点溶液中:![]()
B.![]() 的数量级为
的数量级为![]()
C.M点到N点: 的值不变
的值不变
D.N点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色色斑向d端扩散。下列判断正确的是( )
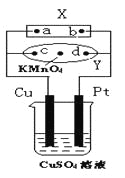
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.烧杯中溶液的pH先减小,后增大
D.Z溶液中SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铜及其化合物以及乙醇、氯化钠的用途广泛。回答下列问题:
(1)基态氮原子中含有______种运动状态不同的电子,与N3-含有相同电子数的四原子分子是_______(写化学式),其立体构型是________。
(2)C、N、O、F四种元素的第一电离能由小到大的顺序为_____。
(3)Cu+价层电子的轨道表达式(电子排布图)为______。CuO在高温下能分解生成Cu2O,其原因是_______。
(4)在加热和Cu的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是____,乙醛分子中H一C—O的键角____ (填“大于”等于”或“小于”)乙醇分子中的H—C—O的键角。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代后有两种不同的结构,其中[Cu( H2O)2(Cl)2]是非极性分子的结构式为________。
(6)如图所示为NaCl晶体的晶胞结构图和晶胞截面图(截面图中的大球为Cl-,小球为Na+);
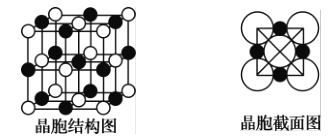
①晶胞中距离1个Na+最近的Cl-有_____个 ,这些C1-围成的图形是___________。
②若晶体密度为ρg●cm-3,阿伏加德罗常数的值用NA表示,则Na+的离子半径为_______pm(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的类别及所含官能团的名称。
(1)CH3CH=CH2____、_________;
(2)HC≡C—CH2CH3__________、__________;
(3)![]() _________、___________;
_________、___________;
(4)![]() _________、_________;
_________、_________;
(5)![]() _________、___________;
_________、___________;
(6)CH3CH2—O—CH3__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1)链状化合物不含碳环,环状化合物不含碳链。(______)
(2)烷烃的官能团是碳碳单键,烯烃的官能团是碳碳双键。(______)
(3)乙酸的分子中含有羧基(![]() )和羟基(—OH)两种官能团。(______)
)和羟基(—OH)两种官能团。(______)
(4)含有相同官能团的有机化合物,一定属于同类物质。(______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析:
①氯化钠固体和氯化氢气体都不导电是因为二者中都不存在离子
②碳酸钠、氢氧化钡、氯化铵都属于离子化合物
③醋酸、烧碱和过氧化钠分别属于酸,碱和碱性氧化物
④氨气、水和硫酸钡分别属于非电解质、弱电解质和强电解质
⑤碳酸钠晶体在空气中风化是化学变化,硫酸铜溶液导电是化学变化
⑥用玻璃棒蘸取溶液进行焰色反应实验,火焰呈黄色说明溶液中含有![]()
⑦用![]() 溶液、品红试液都可以区分CO2和SO2这两种气体
溶液、品红试液都可以区分CO2和SO2这两种气体
上述说法正确的是( )
A.①④⑤⑥B.②④⑦C.①②③⑤D.②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图:
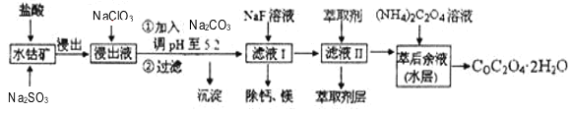
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是_____。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为_____。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____。
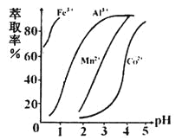
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,在滤液II中适宜萃取的pH为_____左右。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液![]() =____。
=____。
(6)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K=1.8×10-5,H2SO3的电离平衡常数K1=1.2×10-2,K2=1.3×10-8。在通废气的过程中,当恰好形成正盐时,溶液中离子浓度的大小关系为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com