
【题目】Ca可用于研究中药的钙拮抗作用及机理,这里的“45”是指该原子的 ( )
A. 原子序数 B. 中子数 C. 质量数 D. 电子数
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶C中溶液蓝色刚好消失时,立即关闭活塞A。

(1) C中导管末端连接一个多孔球泡D,其作用是 ,可以提高实验的准确度。
(2) C中发生反应为SO2 + I2 +2H2O = H2SO4+ 2HI , I2 是 (氧化剂、还原剂)。
(3) 某同学根据反应:SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl,设计了一个实验,比较SO2与Fe2+ 还 原性的强弱:取少量C中溶液于试管中,滴加2mL氯化铁溶液,摇匀,滴入几滴KSCN溶液,溶液不变红色 , (试剂任选,请完善步骤、现象和结论)。
(4) ① 当流量计B中刚好通过2L尾气时,C中溶液蓝色刚好消失,立即关闭活塞A,容器C中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为 g/L。 (相对原子质量: Ba-137 S-32 O-16)
② 若洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验。(图中夹持及尾气处理装置均已略去)
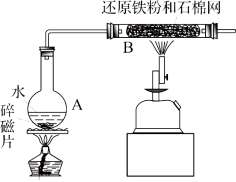
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。装置B中发生反应的化学方程式是 。
(2)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法 。
(3)若(2)实验中未检验到Fe3+的存在,则可能的原因是 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题。
Ⅰ.已知甲和乙为中学常见金属单质,丙和丁为常见气体单质,A~E为常见化合物;A为淡黄色固体,常温下B为液体,C的焰色反应为黄色。试回答下列问题:
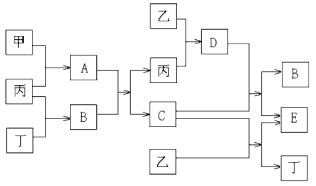
(1)A和E的化学式分别为____________、_____________;
(2)A+B → C+丙的化学方程式:____________________________;
(3)D+C → B+E的离子方程式:________________________________;
(4)1 mol甲和1 mol乙混合投入到足量的B中,在标准状况下,最多能产生________L丁气体。
Ⅱ.在标准状况下,取甲、乙、丙各30mL相同浓度的盐酸,然后分别慢慢加入组成相同的铝镁混合物,得下表中有关数据(反应前后溶液体积不发生变化)。
实验序号 | 甲 | 乙 | 丙 |
混合物质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
(1)甲组实验中,盐酸__________(填“过量”、“适量”或“不足”);
乙组实验中,盐酸__________(填“过量”、“适量”或“不足”)。
(2)盐酸的物质的量的浓度为_____________mol/L。
(3)混合物中Mg和Al的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验,实验结果与预测的现象不一致的是

①中的物质 | ②中的物质 | 预测①的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下某些一元弱酸的电离常数:
弱酸 | HCN | HF | CH3COOH | HNO2 |
电离常数 | 4.9×10-10 | 7.2×10-4 | 1.8×10-5 | 6.4×10-6 |
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A.HCN B.HF C.CH3COOH D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种同分异构体。A的结构简式如下:
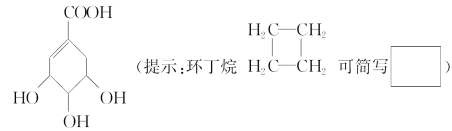
(1)A的分子式是__________________________。
(2)A与溴的四氯化碳溶液反应的化学方程式(有机物用结构简式表示)是___________。
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是_______________。
(4)17.4 g A与足量碳酸氢钠溶液反应,生成二氧化碳的体积(标准状况)为________。
(5)A在浓硫酸作用下加热可得到B(B的结构简式为(![]() ),其反应类型是________。
),其反应类型是________。
(6)B的同分异构体中既含有酚羟基又含有酯基的共有________种,写出其中一种同分异构体的结构简式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的化学反应速率为____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
2SO3(g) , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,用O2浓度变化来表示的化学反应速率为____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
(2)下图表示在密闭容器中反应:2SO2+O2 ![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是 ;b-c过程中改变的条件可能是 ;若在c处增大压强时,反应速度变化和达平衡情况画在c-d处,并标出V正和V逆。
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是 ;b-c过程中改变的条件可能是 ;若在c处增大压强时,反应速度变化和达平衡情况画在c-d处,并标出V正和V逆。

(3)以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡后,容器内温度将____________[填“升高”、“降低”或“不变”(容器不与外界进行热交换)];达新平衡时,容器内混合气体的平均相对分子质量与原平衡相比_____________(填“增大”、“减小”或“相等”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com