
����Ŀ����1����֪���������Ȼ�ѧ����ʽ��
H2(g)+ 1/2O2(g) ![]() H2O(l) ��H=��285.8 kJ��mol��1
H2O(l) ��H=��285.8 kJ��mol��1
C2H4(g)+ 3O2(g) ![]() 2CO2(g)+2H2O(l) ��H=��1411.0 kJ��mol��1
2CO2(g)+2H2O(l) ��H=��1411.0 kJ��mol��1
ʵ����H2��C2H4�Ļ�����干5 mol����ȫȼ������Һ̬ˮʱ����4242kJ,����������H2��C3H8���������____________��
��2����֪�����Ȼ�ѧ����ʽ:
��CH3COOH(l) + 2O2(g) ![]() 2CO2(g) + 2H2O(l)����H1=�D870.3 kJ��mol��1;
2CO2(g) + 2H2O(l)����H1=�D870.3 kJ��mol��1;
��C(s) + O2(g) ![]() CO2(g)����H2=�D393.5 kJ��mol��1;
CO2(g)����H2=�D393.5 kJ��mol��1;
��H2(g)+1/2 O2(g)![]() H2O(l)����H3=�D285.8 kJ��mol��1��
H2O(l)����H3=�D285.8 kJ��mol��1��
��Ӧ2C(s)+2H2(g)+O2(g)![]() CH3COOH(l)����HΪ______________kJ��mol��1��
CH3COOH(l)����HΪ______________kJ��mol��1��
��3����֪���з�Ӧ: ��SO2(g)+2OH��(aq)![]() SO32��(aq)+H2O(l)������H1
SO32��(aq)+H2O(l)������H1
��ClO�� (aq)+ SO32�� (aq)![]() SO42�� (aq)+Cl��(aq) ��H2
SO42�� (aq)+Cl��(aq) ��H2
��CaSO4(s)![]() Ca2+(aq)+ SO42�� (aq) ��H3 ��Ӧ
Ca2+(aq)+ SO42�� (aq) ��H3 ��Ӧ
SO2(g)+Ca2+(aq)+ClO��(aq)+2OH��(aq)![]() CaSO4(s)+H2O(l)+Cl��(aq)����H=_____________��
CaSO4(s)+H2O(l)+Cl��(aq)����H=_____________��
��4����֪:��̼��ȼ������H1= a kJ��mol��1
��S(s)+2K(s)![]() K2S(s)����H2=b kJ��mol��1
K2S(s)����H2=b kJ��mol��1
��2K(s)+N2(g)+3O2(g)![]() 2KNO3(s)����H3=c kJ��mol��1
2KNO3(s)����H3=c kJ��mol��1
�ڻ�ҩ��ը���Ȼ�ѧ����ʽΪ:
S(s)+2KNO3(s)+3C(s)![]() K2S(s)+N2(g)+3CO2(g)����H= ______________ kJ��mol��1
K2S(s)+N2(g)+3CO2(g)����H= ______________ kJ��mol��1
��5����2O2(g)+N2(g)![]() N2O4(l)��������H1 = a
N2O4(l)��������H1 = a
��N2(g)+2H2(g)![]() N2H4(l) ��H2=b ��O2(g)+2H2(g)
N2H4(l) ��H2=b ��O2(g)+2H2(g)![]() 2H2O(g) ��H3=c
2H2O(g) ��H3=c
��Ӧ2N2H4(l)+N2O4(l)![]() 3N2(g)+4H2O(g) ��H4=___________________��
3N2(g)+4H2O(g) ��H4=___________________��
���𰸡� 1��1 ��488.3 ��H1+��H2�D��H3 3a+b�Dc 2c��2b��a
��������(1)H2��C2H4�Ļ�����干5mol�����������ʵ���Ϊx����ϩ���ʵ���Ϊ(5-x)����ȫȼ������Һ̬ˮʱ����4242 kJ
H2(g)+ ![]() O2(g)�TH2O(1)��H=-285.8kJ/mol
O2(g)�TH2O(1)��H=-285.8kJ/mol
1 285.8kJ
x 285.8xkJ
C2H4(g)+ 3O2(g) ![]() 2CO2(g)+2H2O(l) ��H=��1411.0 kJ��mol��1
2CO2(g)+2H2O(l) ��H=��1411.0 kJ��mol��1
1 1411.0kJ
5-x 1411.0(5-x)kJ
285.8xkJ+1411.0��(5-x)kJ=4242kJ����ã�x=2.5mol�����������H2��C2H4�����֮�ȵ������ʵ���֮��=2.5mol��2.5mol=1��1���ʴ�Ϊ��1��1��
(2)��֪����CH3COOH(l)+2O2(g)�T2CO2(g)+2H2O(l)��H1=-870.3kJ/mol����C(s)+O2(g)�TCO2(g)��H2=-393.5kJ/mol����H2(g)+ ![]() O2(g)�TH2O(l)��H3=-285.8kJ/mol�����ø�˹���ɽ�����2+����2-�ٿɵã�2C(s)+2H2(g)+O2(g)=CH3COOH(l)��H=2��(-393.5kJ/mol)+2��(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol�������Ȼ�ѧ����ʽΪ2C(s)+2H2(g)+O2(g)=CH3COOH(l)����H=-488.3kJ/mol���ʴ�Ϊ��-488.3kJ/mol��
O2(g)�TH2O(l)��H3=-285.8kJ/mol�����ø�˹���ɽ�����2+����2-�ٿɵã�2C(s)+2H2(g)+O2(g)=CH3COOH(l)��H=2��(-393.5kJ/mol)+2��(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol�������Ȼ�ѧ����ʽΪ2C(s)+2H2(g)+O2(g)=CH3COOH(l)����H=-488.3kJ/mol���ʴ�Ϊ��-488.3kJ/mol��
(3)��֪: ��SO2(g)+2OH��(aq)=SO32�� (aq)+H2O(l)��H1����ClO�� (aq)+ SO32�� (aq)= SO42�� (aq)+Cl��(aq) ��H2����CaSO4(s)=Ca2+(aq)+ SO42�� (aq) ��H3 �����ݸ�˹���ɣ�����+��-�۵�SO2(g)+Ca2+(aq)+ClO��(aq)+2OH��(aq)=CaSO4(s)+H2O(l)+Cl��(aq)��H=��H1+��H2�D��H3���ʴ�Ϊ����H1+��H2�D��H3��
(4)̼��ȼ������H1=a kJmol-1�����Ȼ�ѧ����ʽΪ��C(s)+O2(g)=CO2(g)��H1=a kJmol-1����S(s)+2K(s)�TK2S(s)��H2=b kJmol-1����2K(s)+N2(g)+3O2(g)�T2KNO3(s)��H3=c kJmol-1��������ʽ����3+��-�۵�S(s)+2KNO3(s)+3C(s)�TK2S(s)+N2(g)+3CO2(g)������H=x kJmol-1=(3a+b-c)kJmol-1������x=3a+b-c���ʴ�Ϊ��3a+b-c��
(5)��2O2(g)+N2(g)=N2O4(l)��H1 = a����N2(g)+2H2(g)=N2H4(l) ��H2=b����O2(g)+2H2(g)=2H2O(g) ��H3=c�����ݸ�˹���룬������2-����2-�ٵã�2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H4= 2c��2b��a���ʴ�Ϊ��2c��2b��a��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼ԭ��֮��ֻ�Ե�����ϵı���������ͨʽΪ��������
A. CnH2n+2 B. CnH2n C. CnH2n��2 D. CnHn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij���˵���Һ�������Ƶ�Cu(OH)2��Һ�У���ʱ����۲쵽��ɫ������˵������Һ�к��У� ��
A.����B.�ƾ�C.����D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������ˮ��Һ��ֻ���ܺ������������е������֣�K����Al3����Fe3����Mg2����Ba2����NH![]() ��Cl����CO
��Cl����CO![]() ��SO
��SO![]() ����ȡ����100 mL��Һ��������ʵ�飺
����ȡ����100 mL��Һ��������ʵ�飺
�ٵ�һ�ݼӹ���NaOH��Һ���Ⱥ�,ֻ�ռ�������0��02mol,��������,ͬʱ�õ���Һ�ס�
���ڼ���Һ��ͨ�����CO2�����ɰ�ɫ���������������ˡ�ϴ�ӡ����գ�����Ϊ1��02 g��
�۵ڶ��ݼ�����BaCl2��Һ��,�ð�ɫ��������������������ϴ�ӡ������,����Ϊ11��65 g��
��������ʵ��ش�
��1��һ�������ڵ�������______������ȷ���Ƿ���ڵ�������______��
��2����ȷ����Һ�п϶����ڵ����Ӽ���Ũ����ֵ��Χ���ɲ���������
���ӷ���________��Ũ��_________mol/L��
���ӷ���________��Ũ��_________mol/L��
���ӷ���________��Ũ��_________mol/L��
���ӷ���________��Ũ��_________mol/L��
��3����Һ���Ƿ���K+������ͨ��ʵ�鷽����֤����������ʵ����������������ۣ�__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ��ݻ��������н��з�Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g)����֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 molL-1��0.1 molL-1��0.2 molL-1������Ӧ��ƽ��ʱ�����ܴ��ڵ������ǣ� ��
2SO3(g)����֪��Ӧ������ijһʱ��SO2��O2��SO3��Ũ�ȷֱ�Ϊ0.2 molL-1��0.1 molL-1��0.2 molL-1������Ӧ��ƽ��ʱ�����ܴ��ڵ������ǣ� ��
A. SO2Ϊ0.4 molL-1��O2Ϊ0.2 molL-1 B. SO2Ϊ0.25 molL-1
C. SO2��SO3��Ϊ0.15 molL-1 D. SO3Ϊ0.4 molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������������������������������·�Ӧ��2SO2(g)��O2(g)![]() 2SO3(g) ��H ��0
2SO3(g) ��H ��0
��1�������¶ȣ��÷�ӦKֵ______����������ת����______��(���Ͼ���������������С������������)
��2��600 ��ʱ����һ�ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ��ʾ����Ӧ����ƽ��״̬��ʱ����______________________��
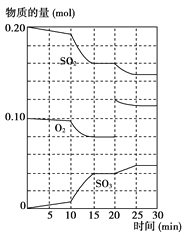
��3������ͼ�жϣ���Ӧ������20 minʱ�����߷����仯��ԭ����__________________(�����ֱ���)��
��4������������Ӧ��ij����������˵���÷�Ӧ�Ѵﵽƽ��״̬����_______��
A .SO2������������SO3�������������
B. ����a mol SO2��ͬʱ����a mol SO3
C. �����Ũ�Ȳ��ڷ����仯
D.������ϵ��ѹǿ���ٷ����仯
E. ������ϵ�������ܶȲ��ٱ仯
F. ��H���ٷ����仯
G.������SO2��O2��SO3��Ũ�ȱ���2:1:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����A��һ�������¼��ȷֽ⣬���ﶼ�����塣�ֽⷽ��ʽΪ2A=B+2C+2D�����������Ļ�����������������ܶ�Ϊd����A��ʽ��Ϊ�� ��
A. 7d B. 5d C. 2.5d D. 2d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ������Ҫ0.2mol/L NaOH��Һ500mL��0.5mol/L������Һ450mL��������������Һ����������ش��������⣺
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����������ţ�������������Һ�����õ��IJ��������������������ƣ��� 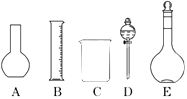
��2������ƿ��������Һ����Ҫ����������ƿ�ϱ������������е�����д��ţ���
���¶� ��Ũ�� ������ ��ѹǿ ����ʽ���ʽ �̶���
��3������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ� ��
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ
B��ȷ��ȡ���������������ƹ������ձ��У��ټ�������ˮ��Լ50mL�����ò���������������ʹ�����ܽ⣬��ȴ������
C��������ƿ�ǽ���ҡ��
D�����ܽ������������Һ�ز�����ע������ƿ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�2��3cm��
��4�����ݼ��㣬����0.2mol/L NaOH��Һ500mL�� NaOH���������Ϊ��g��
��5�����ƹ������������ձ��н�Ũ�������ϡ�ͣ�ϡ��ʱ���������ǣ� ��
��6���������Ƶ�ϡH2SO4���вⶨ������ʵ��Ũ��С��0.5mol/L���������������Щ��������������Ũ��ƫС����д��ĸ�� ��
A.����Ͳ��ȡŨ����ʱ��������Ͳ�Ŀ̶�
B.����ƿδ���T����������Һ
C.Ũ�������ձ���ϡ�ͺ�δ��ȴ������ת�Ƶ�����ƿ�У������ж���
D.������ƿת��ʱ��������Һ�彦��
E.������ƿ�ж���ʱ��������ƿ�̶���
F.�ձ�δ����ϴ��
G.���ݺ�����ƿ������ҡ�ȣ����ú�Һ�治���̶��ߣ��ټ�ˮ���̶��ߣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com