
【化学——选修化学与技术】(15分)现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是 _____________________ ________、___________________________________ 。
(2)反应Ⅰ的产物为(填化学式) ___________________ 。
(3)反应Ⅲ的离子方程式为 ____________________________________________________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 ___________
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
| A.反应中被还原的元素只有氧 | B.反应生成的SO2直接排放会污染环境 |
| C.SO2既是氧化产物又是还原产物 | D.当有8mol铜生成时,转移电子数目为100NA |
共15分。(1)SO2会导致大气污染(1分),同时要消耗大量的热能(1分)
(2)FeS2(1分)、CuS(1分) (3)4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O(2分)
(4)该温度下,硫酸铜的溶解度小于氯化铜(2分)
(5)BCD(2分,漏选1个得1分,错选或漏选2个以上不得分)
(6)①SO2 + 2Fe3++ 2H2O=SO42-+ 2Fe2++ 4H+(2分) ②12.00%(2分
解析试题分析:(1)在高温下煅烧,则会要消耗大量的热能;其次生成的SO2会导致大气污染。
(2)根据黄铜矿中元素的化合价、单质S的化学性质以及反应Ⅱ的离子方程式可知,反应Ⅰ的产物为FeS2、CuS。
(3)反应Ⅲ是氧气氧化CuCl2-离子,所以该反应的离子方程式为4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O。
(4)由于该温度下,硫酸铜的溶解度小于氯化铜,所以会析出硫酸铜晶体。
(5)根据方程式可知,铜和氧元素的化合价降低,被还原,A不正确;SO2是大气污染物,不能随意排放,B正确;S的化合价升高,所以SO2既是氧化产物又是还原产物,C正确;当有8mol铜生成时,转移电子的物质的量是8mol×2+21mol×4=100mol,则选项D正确,答案选BCD。
(6)①硫酸铁能氧化SO2生成硫酸,则①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为SO2 + 2Fe3++ 2H2O=SO42-+ 2Fe2++ 4H+。
②消耗K2Cr2O7的物质的量是0.02000 mol/L×0.025L=0.0005mol,则根据电子电子守恒可知,亚铁离子的物质的量是0.0005mol×6=0.003mol,所以根据方程式可知,SO2的物质的量是0.003mol÷2=0.0015mol,因此反应Ⅳ所得气体中SO2的体积分数为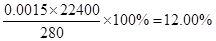 。
。
考点:考查氧化还原反应反应中产物的判断、计算以及方程式的配平
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是准确判断出有关元素的化合价变化情况,如何结合题意并借助于电子得失守恒进行判断和计算即可。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com