
【题目】(1)标准状况下,3.4gNH3与________LCO气体所含有电子数相同。
(2)0.2L0.5mol·L-1Al2(SO4)3溶液和0.5L0.5mol·L-1Na2SO4溶液,所含SO42-离子浓度之比为_________。
(3)标准状况下,NH3 与 CH4 组成的混合气体的平均密度为 0.75g/L,则 NH3 的体积分数为__________
(4)配制 100mL 2mol/L 的 H2SO4 溶液,取配制后的溶液 20mL,加入足量的锌,生成标况下 氢气的体积为_____L。
(5)已知 16g A 和 20g B 恰好完全反应生成 0.04mol C 和 32g D,则 C 的摩尔质量为______
【答案】3.23:180%0.896100g/mol
【解析】
(1)标准状况下,3.4gNH3的物质的量为![]() ,所含有电子数为0.2mol×10×NA=2NA,含有2NA个电子的CO气体的物质的量为
,所含有电子数为0.2mol×10×NA=2NA,含有2NA个电子的CO气体的物质的量为![]() ,体积为
,体积为![]() ;
;
(2)0.2L0.5mol·L-1Al2(SO4)3溶液所含SO42-离子浓度为3×0.5mol/L=1.5mol/L,0.5L0.5mol·L-1Na2SO4溶液所含SO42-离子浓度为1×0.5mol/L=0.5mol/L,故两者所含SO42-离子浓度之比为1.5mol/L:0.5mol/L =3:1;
(3)标准状况下,密度为0.75gL-1的NH3与CH4组成的混合气体的平均摩尔质量为:M=0.75gL-1×22.4L/mol=16.8g/mol,设混合气体中NH3、CH4的物质的量分别为x、y,则:
![]() =16.8,整理可得:x:y=4:1,相同条件下气体体积之比等于物质的量之比,则混合气体中NH3的体积分数为:
=16.8,整理可得:x:y=4:1,相同条件下气体体积之比等于物质的量之比,则混合气体中NH3的体积分数为:![]() ×100%=80%;
×100%=80%;
(4)所取硫酸溶液中n(H2SO4)=0.02L ×2mol/L=0.04mol,加入足量的锌,根据反应Zn+H2SO4=ZnSO4+H2↑可知,生成标况下氢气的体积为0.04mol ×22.4L/mol=0.896L;
(5)16gA和20gB恰好完全反应生成0.04molC和32gD,根据质量守恒知,C的质量为16g+20g-32g=4g;M=![]() =
=![]() =100g/mol。
=100g/mol。


科目:高中化学 来源: 题型:
【题目】海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是( )

A. 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B. 步骤②中反应利用的原理是:相同条件下NaHCO3的溶解度比NaCl小
C. 步骤③在工业上通过向母液中加NaOH固体实现
D. 步骤④利用了Br2的挥发性、还原性,该步的作用是富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各题所给出的数据,得出的结论正确的是( )
A. 通入标准状况下 HCl 气体 11.2L,可使 1 L 浓度为 0.5mol/L 的盐酸物质的量浓度增大到 1mol/L
B. 在 10%的 NaOH 溶液中,平均每 9 个水分子溶有 1 个 OH-
C. 将 10g 碳酸钙粉末加水配成 100ml 溶液,CaCO3 物质的量浓度为 1mol/L
D. 4g NaOH 溶解在 10mL 水中,再稀释成 1L,从中取 1mL,这 1mL 溶液的物质的量浓度为 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中有很多有趣的分子,比如图中所示分子被化学家命名为“小狗烯”,下列关于“小狗烯”的说法错误的是
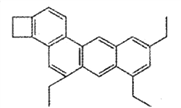
A. “小狗烯”的分子式是C26H26 B. “小狗烯”中含有四个苯环
C. “小狗烯”中所有碳原子一定共面 D. “小狗烯”可以发生加成反应、氧化反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 0.100 | 0.076 | 0.060 | 0.060 | 0.050 | 0.050 |
N2 | 0 | 0.012 | 0.020 | 0.020 | 0.025 | 0.025 |
CO2 | 0 | 0.012 | 0.020 | 0.020 | 0.011 | 0.011 |
(1
(2)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10mL10%的NaOH溶液,再加入约2 mL1%的硫酸铜溶液,得到强碱性的混合液。下列各对物质不能用这碱性混合物鉴别的是( )
A. 葡萄糖与蔗糖 B. 蛋白质与淀粉
C. 硬脂酸与油酸 D. 甲酸钠与乙酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn﹣的核外电子排布相同,则下列关系式正确的是( )
A.a=b+m+n
B.a=b﹣m+n
C.a=b+m﹣n
D.a=b﹣m﹣n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇. 某化学兴趣小组对亚硝酸钠进行多角度探究:
i.亚硝酸钠的制备
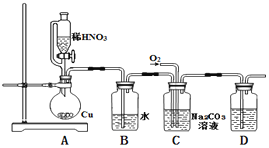
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____.
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_______________。
ii. 探究亚硝酸钠与硫酸反应气体产物成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O ②气体液化的温度:NO2:21℃,NO:﹣152℃

(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是___________.
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A、C、______、______、______.
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO,依据的现象是_________________.
②装置B的作用是____________________.
iii. 设计实验证明酸性条件下NaNO2具有氧化性:___________。
供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com