
【题目】海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是( )

A. 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B. 步骤②中反应利用的原理是:相同条件下NaHCO3的溶解度比NaCl小
C. 步骤③在工业上通过向母液中加NaOH固体实现
D. 步骤④利用了Br2的挥发性、还原性,该步的作用是富集
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)反应Cl2+H2OH++Cl-+HC1O其化学平衡常数的K表达式为:_________
(2)常温下,向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D.溶液中 减小
减小
(3)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-H++SO42-.
请据此回答下列有关问题:
①Na2SO4溶液呈______(填“弱酸性”、“中性”或“弱碱性”).
②写出下列反应的离子方程式
H2SO4溶液与BaCl2溶液反应______;
H2SO4溶液与Na2SO4溶液反应______.
③在0.1molL-1的Na2SO4溶液中,下列粒子浓度关系式正确的是______.(填编号)
A.c(SO42-)+c(HSO4-)=0.1molL-1
B.c(SO42-)+c(HSO4-)=2c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学要在奥运五连环中填入物质,使相连物质间能发生反应,不相连物质间不能发生反应。你认为“五连环”中有空缺的一环应填入的物质是( )

A. 硫酸 B. 氧气 C. 二氧化碳 D. 氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H(4-苯基-2-丁酮)是一种重要的医药中间体。以下是合成H的一种路线:
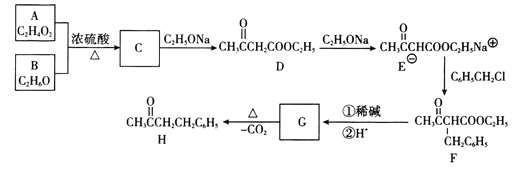
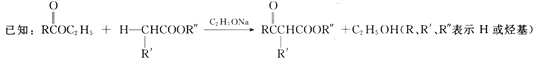
回答下列问题:
(1)A的化学名称为__________________。
(2)D中官能团的名称为___________,E→F的化学反应类型为___________________。
(3)G的结构简式为________________________。
(4)写出C→D的化学反应方程式:__________________________________________。
(5)H存在多种同分异构体,满足下列条件的同分异构体共___________种,其中核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的结构简式为__________________________。
①含有苯环且只有一个支链;②能发生银镜反应
(6)结合信息,写出用乙酸乙酯为原料制备化合物丙酮(CH3COCH3)的合成路线:___________________________________________________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要制备纯净的氯化钾。现含有少量K2SO4的氯化钾样品,按照如图所示的实验方案进行提纯。

(1)检验加入BaCl2溶液后![]() 是否沉淀完全的操作为____________________________。
是否沉淀完全的操作为____________________________。
(2)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由:_____________________。
(3)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,他的思路如下:

请写出①②③④⑤溶质或沉淀的化学式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有34 g 某气体,它的摩尔质量为17g.mol-1。则:
(1)该气体为_____________mol
(2)该气体所含分子数为_________ NA
(3)该气体在标准状况下的体积为_________ L
(4) ________g H2O中的氧原子数目与保准状况22.4LCO2中的氧原子数目相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,3.4gNH3与________LCO气体所含有电子数相同。
(2)0.2L0.5mol·L-1Al2(SO4)3溶液和0.5L0.5mol·L-1Na2SO4溶液,所含SO42-离子浓度之比为_________。
(3)标准状况下,NH3 与 CH4 组成的混合气体的平均密度为 0.75g/L,则 NH3 的体积分数为__________
(4)配制 100mL 2mol/L 的 H2SO4 溶液,取配制后的溶液 20mL,加入足量的锌,生成标况下 氢气的体积为_____L。
(5)已知 16g A 和 20g B 恰好完全反应生成 0.04mol C 和 32g D,则 C 的摩尔质量为______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com