
【题目】按要求回答下列问题:
(1)反应Cl2+H2OH++Cl-+HC1O其化学平衡常数的K表达式为:_________
(2)常温下,向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D.溶液中 减小
减小
(3)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-H++SO42-.
请据此回答下列有关问题:
①Na2SO4溶液呈______(填“弱酸性”、“中性”或“弱碱性”).
②写出下列反应的离子方程式
H2SO4溶液与BaCl2溶液反应______;
H2SO4溶液与Na2SO4溶液反应______.
③在0.1molL-1的Na2SO4溶液中,下列粒子浓度关系式正确的是______.(填编号)
A.c(SO42-)+c(HSO4-)=0.1molL-1
B.c(SO42-)+c(HSO4-)=2c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
【答案】  CD 弱碱性 SO42-+H2OOH-+HSO4- HSO4-+Ba2+=BaSO4↓+H+;H++SO42-=HSO4- AC
CD 弱碱性 SO42-+H2OOH-+HSO4- HSO4-+Ba2+=BaSO4↓+H+;H++SO42-=HSO4- AC
【解析】(1)平衡常数表达式为生成物浓度的幂之积与反应物浓度的幂之积的比值;正确答案:![]() ;
;
(2) 0.1mol/L醋酸溶液中加水稀释后,平衡右移,醋酸的电离程度增大,n(CH3COOH)减少, n(CH3COO-)增大 ,n(H+)增大,但是c(CH3COOH)、c(CH3COO-)、 c(H+)都减少,根据KW= c(H+)c(OH-)=10-14, c(OH-)增大;A.n(CH3COO-)、n(H+)都增大,答案A错 误;B.加水稀释,醋酸的电离程度增大,c(H+)减少,B错 误;C. 公式上下同乘以c(H+)得到以下式子: ![]() K只与温度有关,温度不变,K不变,为常数;C正确;D.醋酸加水稀释,溶液中c(H+)= c(H+)水+ c(H+)醋酸,所以
K只与温度有关,温度不变,K不变,为常数;C正确;D.醋酸加水稀释,溶液中c(H+)= c(H+)水+ c(H+)醋酸,所以 减小,D正确;正确答案:CD;
减小,D正确;正确答案:CD;
(3)①根据题意,Na2SO4为强碱弱酸盐,水解显碱性,SO42-+H2OOH-+HSO4- ;正确答案:溶液呈弱碱性。
②弱酸根HSO4-和Ba2+反应生成BaSO4沉淀;正确答案: HSO4-+Ba2+=BaSO4↓+H+;硫酸钠为弱酸强碱盐,硫酸为强酸,二者反应生成硫酸氢钠;正确答案:SO42-+H+=HSO4- ;
③A.c(SO42-)+c(HSO4-)=0.1molL-1 ,物料守恒,A正确;
B.2c(SO42-)+2c(HSO4-)=c(Na+),B错误;
C.c(OH-)=c(H+)+c(HSO4-),质子守恒,C正确;
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),D错误。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式,书写不正确的是
A. 铁与水蒸汽反应:3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
B. 铝与足量NaOH溶液反应:2Al + 2OH-+ 2H2O ![]() 2AlO2-+ 3H2↑
2AlO2-+ 3H2↑
C. 稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2+ + SO42- ![]() BaSO4↓
BaSO4↓
D. 用Cl2制漂白液:Cl2+2OH-=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式
(1)工业上制备氯乙烯_____________
(2)2-氯丙烷与KOH 的乙醇溶液共热____________
(3)实验室制乙烯__________
(4)中苯在铁粉催化下与溴单质反应__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知20种氨基酸的平均相对分子质量是128,现有一蛋白质分子由两条多肽链组成,共有98个肽键,此蛋白质的相对分子质量最接近于( )
A. 12800 B. 12544 C. 11036 D. 12288
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的![]() 气体和
气体和![]() 气体,其分子数之比为 ______ ,氧原子数之比为 ______ ,相同条件下
气体,其分子数之比为 ______ ,氧原子数之比为 ______ ,相同条件下![]() 同温同压
同温同压![]() 的体积之比为 ______ ,密度之比为 ______ .
的体积之比为 ______ ,密度之比为 ______ .
(2)![]() 与
与![]() 的混合气体中,氧元素的质量分数为
的混合气体中,氧元素的质量分数为![]() ,则
,则![]() 与
与![]() 的物质的量之比是 ______ ,这种混合气体的密度是同温同压下氧气密度的 ______ 倍
的物质的量之比是 ______ ,这种混合气体的密度是同温同压下氧气密度的 ______ 倍![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. Fe(SCN)3溶液中加入固体KSCN后颜色变深
D. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“五室电渗析法”处理含硫酸钠废水的原理如图所示,以石墨为电极材料,室与室之间用离子交换膜分开(阳膜和阴膜分别只允许阳离子、阴离子通过),下列说法不正确的是 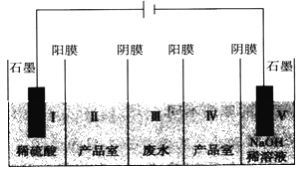
A. 阳极反应式为2H2O-4e-==O2↑+4H+,发生氧化反应
B. 通电片刻后,I、III、V室的pH依次减小、不变、增大
C. 当电路中通过1mol电子时,有1molSO42-从III室进入Ⅱ室
D. 总反应式为Na2SO4+4H2O![]() 2NaOH+H2SO4+O2↑+2H2↑
2NaOH+H2SO4+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含丰富的资源,对海水进行综合利用,可制备一系列物质(见下图),下列说法正确的是( )

A. 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸→过滤
B. 步骤②中反应利用的原理是:相同条件下NaHCO3的溶解度比NaCl小
C. 步骤③在工业上通过向母液中加NaOH固体实现
D. 步骤④利用了Br2的挥发性、还原性,该步的作用是富集
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com