
【题目】(1)相同质量的![]() 气体和
气体和![]() 气体,其分子数之比为 ______ ,氧原子数之比为 ______ ,相同条件下
气体,其分子数之比为 ______ ,氧原子数之比为 ______ ,相同条件下![]() 同温同压
同温同压![]() 的体积之比为 ______ ,密度之比为 ______ .
的体积之比为 ______ ,密度之比为 ______ .
(2)![]() 与
与![]() 的混合气体中,氧元素的质量分数为
的混合气体中,氧元素的质量分数为![]() ,则
,则![]() 与
与![]() 的物质的量之比是 ______ ,这种混合气体的密度是同温同压下氧气密度的 ______ 倍
的物质的量之比是 ______ ,这种混合气体的密度是同温同压下氧气密度的 ______ 倍![]()
【答案】5:45:65:44:53:4![]()
【解析】
:(1)设SO2与SO3均为1g,则n(SO2)=1g/64g.mol-1=1/64mol;n(SO3)=1g/80g.mol-1=1/80mol,则SO2中的n(O)=2n(SO2)=1/32mol,SO3中的n(O)=3n(SO2)=3/80mol,故分子数之比为1/64:1/80=5:4,氧原子数之比为1/32:3/80=5:6.
据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2):V(SO3)=5:4,
密度之比等于摩尔质量之比,即![]() (SO2):
(SO2):![]() (SO3) =64:80=4:5。因此,本题正确答案是: 5:4 5:6 5:4 4:5 。
(SO3) =64:80=4:5。因此,本题正确答案是: 5:4 5:6 5:4 4:5 。
(2) SO2与O2的混合气体中,氧元素的质量分数为70![]() ,则S元素的质量分数=1-70
,则S元素的质量分数=1-70![]() =30
=30![]() ,令混合气体的质量为100g,则S元素质量=100g
,令混合气体的质量为100g,则S元素质量=100g![]() 30
30![]() =30g ,故SO2的质量=30g
=30g ,故SO2的质量=30g![]() .32/64=60g则氧气为40g的质量,SO2的物质的量60g/64g.mol-1=15/16mol ,O2的物质的量=40g/32g.mol-1=5/4mol,则SO2与O2的物质的量之比为15/16mol: 5/4mol=3:4,二者平均相对分子质量=100/(15/16+ 5/4)=45.71,相同条件下,气体的摩尔质量之比等于其物质的量之比,所以混合气体的密度是同温同压下氧气密度的倍数=45.71/32=10/7,因此,本题答案是:3:4 10/7。
.32/64=60g则氧气为40g的质量,SO2的物质的量60g/64g.mol-1=15/16mol ,O2的物质的量=40g/32g.mol-1=5/4mol,则SO2与O2的物质的量之比为15/16mol: 5/4mol=3:4,二者平均相对分子质量=100/(15/16+ 5/4)=45.71,相同条件下,气体的摩尔质量之比等于其物质的量之比,所以混合气体的密度是同温同压下氧气密度的倍数=45.71/32=10/7,因此,本题答案是:3:4 10/7。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 阿伏加德罗常数是12g碳中所含有的碳原子数
B. 已知微粒个数,可通过阿伏加德罗常数计算出微粒的物质的量
C. 阿伏加德罗常数的数值是6.02×1023
D. 阿伏加德罗常数的符号为NA,通常用6.02×1023表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由芳香化合物A合成药物中间体I的一种合成路线如下:
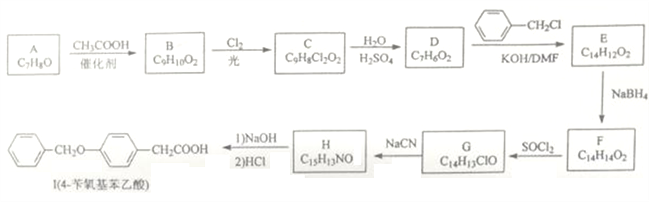
已知:
①A、B、C、D的苯环均只有两个取代基,其中D既能发生银镜反应又能与FeCl3溶液发生显色反应。
②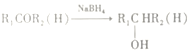
③![]()
回答下列问题:
(1)A的化学名称为______________;H中含氧官能团的名称是_______________。
(2)G生成H的反应类型是__________________。
(3)B、C的结构简式依次为____________、_________________。
(4)C生成D的化学方程式为___________________。
(5)芳香化合物X是E的同分异构体,既能使Br2/CCl4溶液褪色,又能与NaHCO3反应生成CO2,其核磁共振氢谱显示分子中有4种不同化学环境的氢,峰面积之比为6:3:2:1。写出两种符合要求的X的结构简式:______________、________________。
(6)利用上述信息,写出以乙二醇为原料,制备高分子化合物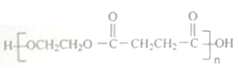 的合成路线________________(其它试剂任用)。
的合成路线________________(其它试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=0的某X溶液中,除H+外,还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量X溶液进行如下一系列实验:

下列有关判断不正确的是( )
A. 生成气体A的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B. 生成沉淀H的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. 溶液X中一定没有的离子仅为:CO32-、Ba2+
D. 溶液X中一定含有的离子是:H+、Fe2+、SO42-、NH4+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)反应Cl2+H2OH++Cl-+HC1O其化学平衡常数的K表达式为:_________
(2)常温下,向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D.溶液中 减小
减小
(3)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-H++SO42-.
请据此回答下列有关问题:
①Na2SO4溶液呈______(填“弱酸性”、“中性”或“弱碱性”).
②写出下列反应的离子方程式
H2SO4溶液与BaCl2溶液反应______;
H2SO4溶液与Na2SO4溶液反应______.
③在0.1molL-1的Na2SO4溶液中,下列粒子浓度关系式正确的是______.(填编号)
A.c(SO42-)+c(HSO4-)=0.1molL-1
B.c(SO42-)+c(HSO4-)=2c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________,试剂a的溶质是_______________(填化学式)
(2)加入试剂b所发生反应的化学方程式为___________________________________。
(3)该方案能不能达到实验目的:_____________,若不能,应如何改进?(若能,此问不用回答)________________________________________。
(4)用分离出的固体B配制100mL 0.5mol/L的溶液B,现有如下可供选择的仪器:
A.胶头滴管 B.烧瓶 C.烧杯 D.药匙 E.量筒 F.托盘天平。
①用托盘天平称得固体B的质量是_________g。
②配制溶液B时,上述仪器中一定不需要使用的有_____________(填字母),还缺少的仪器有__________________________________(写仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高中化学兴趣小组设计合成高分子材料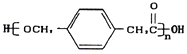
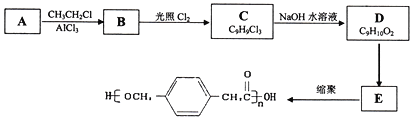
已知:
①A的相对分子质量为92;
②根据结构分析得知同一碳原子上连接两个羟基时结构不稳定,易脱水生成醛或酮;
③D可与新制的氢氧化铜反应;
回答下列问题:
(1)A的结构简式为:___________,B的名称为___________,由B生成C的反应类型是:___________。
(2) 由C生成D的化学方程式为:____________________________,反应过程中生成不稳定的中间产物结构简式为:___________。
(3)写出D转化为E的流程示意图:___________ (示例![]() )
)
(4)E合成高分子材料的化学反应方程式:_________________________________。
(5)E的同分异构体中,满足下列条件的有___________种。
①仅含有苯环,无其他环状结构;
②苯环上只有两个取代基;
③能使三氯化铁溶液显紫色;
④ 含有![]() 的结构;
的结构;
其中核磁共振氢谱表明分子中有六种氢,能发生银镜反应且其峰面积之比为2∶2∶2∶2∶1∶1
请写出其结构简式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,体积均为1L的HA、HB的两种一元酸溶液,分别向其中加水稀释至体积V,pH随lgV的变化关系如图所示。下列说法正确的是
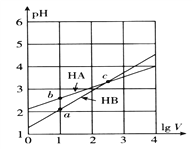
A. HA是弱酸,HB是强酸
B. 相同温度、相同浓度的NaA、NaB溶液的pH,后者大
C. c点处,分别加入足量的锌粒,HA中产生氢气多
D. a、b、c三点,由水电离出来的c(H+)·c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要制备纯净的氯化钾。现含有少量K2SO4的氯化钾样品,按照如图所示的实验方案进行提纯。

(1)检验加入BaCl2溶液后![]() 是否沉淀完全的操作为____________________________。
是否沉淀完全的操作为____________________________。
(2)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由:_____________________。
(3)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,他的思路如下:

请写出①②③④⑤溶质或沉淀的化学式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com