
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. Fe(SCN)3溶液中加入固体KSCN后颜色变深
D. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
【答案】D
【解析】可逆反应2NO2![]() N2O4,加压条件下,体积减小,混合气体各组分的浓度增大,故颜色变深,但增大压强,平衡向气体体积减小的方向移动,即正向移动,颜色逐渐变浅,所以可以用平衡移动原理解释,A项不符合题意;2SO2+O2(g)
N2O4,加压条件下,体积减小,混合气体各组分的浓度增大,故颜色变深,但增大压强,平衡向气体体积减小的方向移动,即正向移动,颜色逐渐变浅,所以可以用平衡移动原理解释,A项不符合题意;2SO2+O2(g)![]() 2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释,B项不符合题意;向硫氰化铁溶液中加入硫氰化钾固体时,硫氰根离子浓度增大,平衡向正反应方向移动,则硫氰化铁浓度增大,溶液的颜色变深,可用平衡移动原理解释,C项不符合题意; H2+I2(g)
2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释,B项不符合题意;向硫氰化铁溶液中加入硫氰化钾固体时,硫氰根离子浓度增大,平衡向正反应方向移动,则硫氰化铁浓度增大,溶液的颜色变深,可用平衡移动原理解释,C项不符合题意; H2+I2(g)![]() 2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释,D项符合题意。
2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释,D项符合题意。


科目:高中化学 来源: 题型:
【题目】燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注。一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
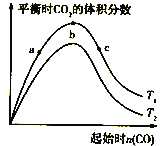
下列有关说法正确的是
A. T1比T2高 B. b点SO2转化率最高
C. b点后曲线下降是因CO体积分数升高 D. 减小压强可提高CO、SO2转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 molL﹣1 HA溶液中逐滴加入0.02 molL﹣1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是
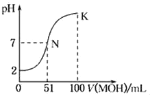
A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A﹣)>c(H+)=c(OH﹣)
C. N点水的电离程度大于K点水的电离程度
D. N→K之间曲线上任意一点都有c(M+) >c(OH﹣)>c(A﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四室式电渗析法制备盐酸和NaOH的装置如图所示。a、b、c 为阴、阳离子交换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过。下列叙述正确的是( )
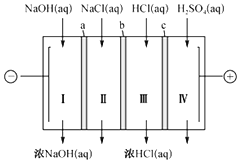
A. b、c 分别依次为阳离子交换膜、阴离子交换膜
B. 通电后Ⅲ室中的Cl-透过c 迁移至阳极区
C. Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D. 电池总反应为4NaCl+6H2O![]() 4NaOH+4HCl+2H2↑+O2↑
4NaOH+4HCl+2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
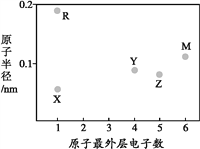
A. 简单离子半径:M<R
B. 氢化物的稳定性:Y<Z
C. M的氢化物常温常压下为气体
D. X、R、Y、Z均存在两种及两种以上的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国双氧水(蒽醌法)生产厂家每年都会排放一定量的废镍触媒(主要含有金属镍,还含有Fe、Ca、Mg等杂质)。以其为原料制备NiSO4的工艺流程如下:
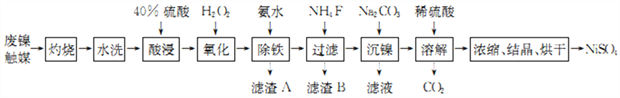
回答下列问题:
(1)废镍触媒灼烧的目的是___________________________。
(2)“酸浸”时,提高镍的浸取率的措施有_________(填字母)。
a.金属镍废料进行“粉碎” b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(3)“氧化”时发生反应的n(Fe2+) ∶n( H2O2) =_________,滤渣B的主要成分的化学式为_________。
(4)已知溶液中c(Fe3+)≤1.0×10-5 mol·L-1 即除铁完全,Ksp[Fe(OH)3]=1×10-39。利用氨水调节溶液pH 可以将铁除去。若测得溶液的pH=3.5,则溶液中的铁是否完全除去? _______________________(列式计算)。
(5)“溶解”过程中反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
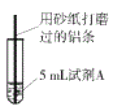
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
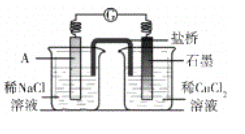
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com