
【题目】我国双氧水(蒽醌法)生产厂家每年都会排放一定量的废镍触媒(主要含有金属镍,还含有Fe、Ca、Mg等杂质)。以其为原料制备NiSO4的工艺流程如下:
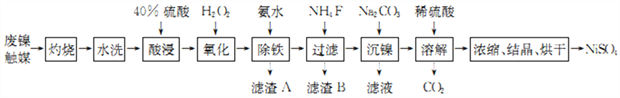
回答下列问题:
(1)废镍触媒灼烧的目的是___________________________。
(2)“酸浸”时,提高镍的浸取率的措施有_________(填字母)。
a.金属镍废料进行“粉碎” b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(3)“氧化”时发生反应的n(Fe2+) ∶n( H2O2) =_________,滤渣B的主要成分的化学式为_________。
(4)已知溶液中c(Fe3+)≤1.0×10-5 mol·L-1 即除铁完全,Ksp[Fe(OH)3]=1×10-39。利用氨水调节溶液pH 可以将铁除去。若测得溶液的pH=3.5,则溶液中的铁是否完全除去? _______________________(列式计算)。
(5)“溶解”过程中反应的离子方程式为_____________________________________。
【答案】 除去废镍触媒中有机物 abd 2∶1 MgF2、CaF2 ![]() =
=![]() =1×10-7.5<1.0×10-5,铁已完全除去 NiCO3+2H+=Ni2++CO2↑+H2O
=1×10-7.5<1.0×10-5,铁已完全除去 NiCO3+2H+=Ni2++CO2↑+H2O
【解析】试题分析:由流程可知,废料经灼烧后,再水洗,然后用硫酸浸取,加双氧水把亚铁离子氧化,加入氨水把铁离子沉淀,加氟化铵沉淀钙离子和镁离子,加碳酸钠沉镍,过滤后,把碳酸镍用硫酸溶解,得到硫酸镍溶液,最后分离提纯得到产品。
(1)灼烧废镍触媒的目的是除去废镍触媒中有机物。
(2)“酸浸”时,a.金属镍废料进行“粉碎”,可以使废料反应更充分; b.用硫酸多次浸取也可以使废料充分反应,提高浸取率;c.浸取时间缩短一半,浸取率会变小; d.适当升高温度,可以使反应更充分,提高了废料的浸取率。综上所述,提高镍的浸取率的措施有abd。
(3)根据化合价升降法,可以判断“氧化”时发生反应的n(Fe2+)∶n(H2O2)=2∶1,滤渣B的主要成分的化学式为MgF2、CaF2。
(4)已知溶液中c(Fe3+)≤1.0×10-5mol·L-1即除铁完全,Ksp[Fe(OH)3]=1×10-39。利用氨水调节溶液pH可以将铁除去。若测得溶液的pH=3.5,则溶液中的c(F3+) ![]() =1×10-7.5<1.0×10-5,所以,铁已完全除去。
=1×10-7.5<1.0×10-5,所以,铁已完全除去。
(5)“溶解”过程中碳酸镍与稀硫酸反应的离子方程式为NiCO3+2H+=Ni2++CO2↑+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】天宫二号空间实验室已于2016 年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:

(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是______(填化学式),该物质的类别属于________(填“碱性氧化物”或“酸性氧化物”) ,实验室中不能用玻璃塞试剂瓶盛放KOH溶液,原因是_______________(用离子方程式表示)
(2)“碳纤维复合材料制品”应用于“天宫二号”的推进系统。碳纤维复合材料具有重量轻、可设计强度高的特点。碳纤维复合材料由碳纤维和合成树脂组成,其中合成树脂是高分子化合物,则制备合成树脂的反应类型是_____________。
(3)太阳能电池帆板是“天宫二号”空间运行的动力源泉,其性能直接影响到“天宫二号”的运行寿命和可靠性。
① 天宫二号使用的光伏太阳能电池,该电池的核心材料是_____,其能量转化方式为_____。
② 下图是一种全天候太阳能电池的工作原理:
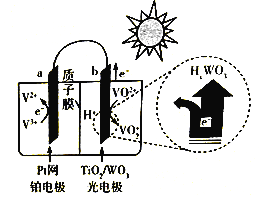
太阳照射时的总反应为V3++ VO2++ H2O=V2++VO2++2H+,则负极反应式为__________;夜间时,电池正极为______(填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯(相对分子质量884)是一种典型的脂肪,在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)。已知要消耗1kg该化合物,常人需快走约200公里(每快走1公里按平均耗能190 kJ计)。则油酸甘油酯的燃烧热△H约为( )
A. 3.8×104kJ·mol-1 B. -3.8×104kJ·mol-1
C. 3.4×104kJ·mol-1 D. -3.4×104kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是
2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是

A.G的指针指向B极
B.U中阳离子向A极移动
C.一段时间后,化学反应达到平衡状态,导线中无电流通过
D.一段时间后,B中溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. Fe(SCN)3溶液中加入固体KSCN后颜色变深
D. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图示细胞中各种化合物或主要元素占细胞鲜重的含量,以下按①②③④顺序排列,正确的是

A. 水、蛋白质、糖类、脂质;N、H、0、C
B. 蛋白质、糖类、脂质、水;0、C. N、H
C. 水、蛋白质、脂质、糖类;H、0、C.N
D. 蛋白质、水、脂质、糖类;C.0、H、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向猪膀胱内注入一半质量分数为30%的蔗糖溶液,扎紧入口,然后将其浸入质量分数为5%的蔗糖溶液中,每隔10 min称一次猪膀胱的重量,能正确表示测定结果的是下图中的
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示是由3个圆所构成的类别关系图,其中I为大圆,II和III分别为大圆之内的小圆。下列选项中符合这种类别关系的是( )

A. I: DNA II: RNA III:核酸
B. I:还原性糖 II:果糖 III:蔗糖
C. I:固醇 II:胆固醇 III:维生素D
D. I:蛋白质 II:酶 III:激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在生产、生活中有许多用途。在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和Al2O3等)制备金属锰等物质,设计流程如下:

己知:Mn2+有较强的还原性,在空气中能被氧气氧化,碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如下表。
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(1)“酸浸”前需将软锰矿粉碎的目的是_____________;酸浸过程MnO2发生反应的离子方程式为_________________。
(2)向滤液I中需先加A物质,再加B物质,若加入的物质均为非金属化合物的溶液,则A为(填物质的名称)_________,B为(填物质的名称)________。滤渣II的成分是_______(填物质的化学式)。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度等,其中浸取率随酸浸时间的变化如图所示:

当浸取时间超过4h时,锰浸取率反而减小,其原因是______________。
(4)测得滤液I中c(Mn2+)=0.1mo/L,则加入B调节溶液pH范围为______。(已知:当某种离子浓度小于1×10-5mo/L时,可认为其沉淀完全。结果保留两位小数)
(5)“沉锰”过程中加入氨水的目的是(从化学平衡移动的角度解释)______________。
(6)写出由MnCO3为原料制备金属锰的过程中所涉及的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com