
【题目】天宫二号空间实验室已于2016 年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:

(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是______(填化学式),该物质的类别属于________(填“碱性氧化物”或“酸性氧化物”) ,实验室中不能用玻璃塞试剂瓶盛放KOH溶液,原因是_______________(用离子方程式表示)
(2)“碳纤维复合材料制品”应用于“天宫二号”的推进系统。碳纤维复合材料具有重量轻、可设计强度高的特点。碳纤维复合材料由碳纤维和合成树脂组成,其中合成树脂是高分子化合物,则制备合成树脂的反应类型是_____________。
(3)太阳能电池帆板是“天宫二号”空间运行的动力源泉,其性能直接影响到“天宫二号”的运行寿命和可靠性。
① 天宫二号使用的光伏太阳能电池,该电池的核心材料是_____,其能量转化方式为_____。
② 下图是一种全天候太阳能电池的工作原理:
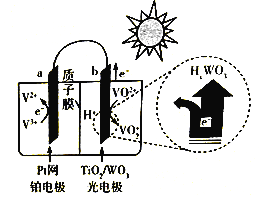
太阳照射时的总反应为V3++ VO2++ H2O=V2++VO2++2H+,则负极反应式为__________;夜间时,电池正极为______(填“a”或“b”)。
【答案】 SiO2 酸性氧化物 SiO2+2OH- =SiO32-+H2O 聚合反应 Si(或答“晶体硅”) 太阳能转化为电能 VO2+ +H2O-e - =VO2++2H+ b
【解析】试题分析:(1)石英是SiO2;SiO2能与强碱反应生成硅酸盐和水; (2)通过聚合反应合成高分子化合物;(3)①太阳能电池的主要原料是高纯硅;②负极失电子发生氧化反应;
解析:(1)石英玻璃的成分是SiO2;SiO2能与氢氧化钠反应生成硅酸钠和水,所以SiO2属于酸性氧化物;SiO2能与氢氧化钾反应生成硅酸钾和水,SiO2+2OH- =SiO32-+H2O,所以实验室中不能用玻璃塞试剂瓶盛放KOH溶液;(2)合成树脂是高分子化合物,制备合成树脂的反应类型是聚合反应;(3)①太阳能电池的主要原料是高纯硅;太阳能电池把太阳能转化为电能;②VO2+失电子生成VO2+,负极反应式是VO2+ +H2O-e - =VO2++2H+;夜晚V2+失电子发生氧化反应,所以a是负极、b是正极。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,溶液体积均为200 ml ,开始时,电解质溶液的浓度均为0.1 mol·L-1 ,工作一段时间后,测得导线上通过了0.02 mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )
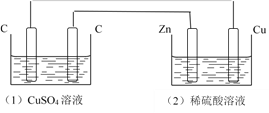
A. (1)、(2)两装置均为电解池
B. (1)、(2)溶液的PH均减小
C. (1)中阳极电极反应式为:4OH--4e-===2H2O+O2↑
D. (1)中阴极上析出0.32 g Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星──土卫六。科学家对探测器发回的数据进了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。下列关于碳氢化合物的叙述正确的是 ( )
A. 碳氢化合物的通式为CnH2n+2 B. 石油的主要成分是碳氢化合物
C. 乙炔是含碳量最高的碳氢氧化物 D. 碳氢氧化物中的化学键都是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂和糖类共性的叙述中不正确的是 ( )
A. 都是人类生命活动的物质基础
B. 一定都是混合物
C. 组成元素一般都是C、H、O
D. 前者全部是小分子,后者部分是大分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注。一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
CaS(s)+3CO2(g) △H=-394.0kJ/mol。保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):
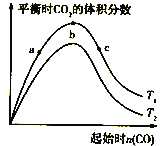
下列有关说法正确的是
A. T1比T2高 B. b点SO2转化率最高
C. b点后曲线下降是因CO体积分数升高 D. 减小压强可提高CO、SO2转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①_____________________________________;②_______________________________________。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.玻璃棒用作引流 b.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:

(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为有色溶液),下层_____色。

Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

(1)欲证明滤液中存在SO42-、OH -,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH - 均存在。
(2)如何洗涤Mg(OH)2沉淀?___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
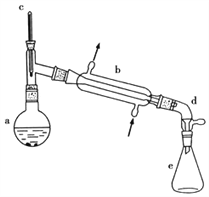

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
(1)合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_________(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________
(4)在本实验的分离过程中,产物应从分液漏斗的_________________(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是________________________
(6)在蒸馏收集产品时, 控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______________(填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀溶解平衡在在生活生产中有着重要应用.
(1)粗制![]() 晶体中常含有杂质
晶体中常含有杂质![]() .
.
①在提纯时为了除去![]() ,常加入合适氧化剂,使
,常加入合适氧化剂,使![]() 氧化为
氧化为![]() ,下列物质最好选用的是 ______ .
,下列物质最好选用的是 ______ .
A. ![]()
![]()
![]() 氯水
氯水![]()
![]() 然后再加入适当物质调整溶液至
然后再加入适当物质调整溶液至![]() ,使
,使![]() 转化为
转化为![]() ,调整溶液pH可选用下列中的 ______ .
,调整溶液pH可选用下列中的 ______ .
A.NaOH ![]()
![]()
![]()
(2)在![]() 下,向浓度均为
下,向浓度均为![]() 的
的![]() 和
和![]() 混合溶液中逐滴加入氨水,先生成 ______ 沉淀
混合溶液中逐滴加入氨水,先生成 ______ 沉淀![]() 填化学式
填化学式![]() ,生成该沉淀的离子方程式为 ______
,生成该沉淀的离子方程式为 ______ ![]() 已知
已知![]() 时
时![]() .
.
(3)向![]() 溶液中加入
溶液中加入![]() 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时, ![]() ______
______ ![]()
(4)向盛有1mL![]() 溶液的试管中滴加2滴
溶液的试管中滴加2滴![]() NaOH溶液,有白色沉淀生成,再滴加2滴
NaOH溶液,有白色沉淀生成,再滴加2滴![]() 溶液,静置
溶液,静置![]() 可以观察到的现象是 ______ ,产生该现象的原因是
可以观察到的现象是 ______ ,产生该现象的原因是![]() 用离子方程式表示
用离子方程式表示![]() ______ 已知:Ksp[
______ 已知:Ksp[![]() ]=4.0x10-38。
]=4.0x10-38。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国双氧水(蒽醌法)生产厂家每年都会排放一定量的废镍触媒(主要含有金属镍,还含有Fe、Ca、Mg等杂质)。以其为原料制备NiSO4的工艺流程如下:
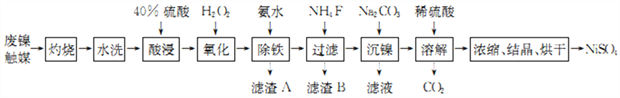
回答下列问题:
(1)废镍触媒灼烧的目的是___________________________。
(2)“酸浸”时,提高镍的浸取率的措施有_________(填字母)。
a.金属镍废料进行“粉碎” b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(3)“氧化”时发生反应的n(Fe2+) ∶n( H2O2) =_________,滤渣B的主要成分的化学式为_________。
(4)已知溶液中c(Fe3+)≤1.0×10-5 mol·L-1 即除铁完全,Ksp[Fe(OH)3]=1×10-39。利用氨水调节溶液pH 可以将铁除去。若测得溶液的pH=3.5,则溶液中的铁是否完全除去? _______________________(列式计算)。
(5)“溶解”过程中反应的离子方程式为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com