
【题目】化学与人类的发展密不可分,以下不属于化学对人类贡献的是( )
A.药物和保健品的研制
B.指南针的发明与应用
C.新型高分子化合物的合成
D.合金材料的生产
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式______________。
(2)Fe元素位于周期表的________区;Fe与CO易形成配合物Fe(CO)5,原子数目和价电子总数相同的微粒互为等电子体,等电子体具有相似的结构特征,与CO分子互为等电子体的分子和离子分别为________和________(填化学式)。
(3)在CH4和C2H2中,碳原子采取sp3杂化的分子是_________________。
(4)根据VSEPR理论预测ED4-离子的空间构型为________。
(5)B、C、D、E原子相互形成的常见化合物分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为______________________(任写1种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
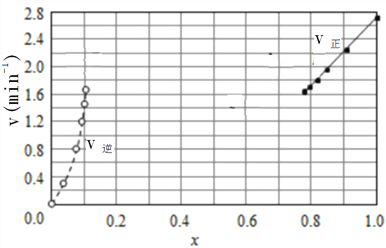
(2)Bodensteins研究了如下反应:2HI(g)![]() H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
A. 达平衡时间甲比乙短
B. 乙容器中再充入等物质的量的SO2和O2,重新达平衡时转化率减小
C. 达平衡时,甲中SO2的浓度比乙中SO2的浓度大
D. 达平衡时,甲的转化率比乙低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液配制说法错误的是( )
A. 称取12.5g胆矾(CuSO4·5H2O)溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol·L-1
B. 取58.5 g NaCl固体放入1 L水中充分溶解,所得溶液中NaCl的物质的量浓度为1 mol·L-1
C. 将100g5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10%
D. 将浓度为2 mol·L-1硫酸钠溶液10 mL加水稀释至200 mL,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: (已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
 请回答下列问题:
请回答下列问题:
(1)操作①加热的目的是________________
(2)操作②除用BaCl2溶液外,还可用________。
(3)操作②,判断SO42-已除尽的方法是_____________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是_________。
(5)操作④的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水玻璃中通入少量的CO2气体,充分反应后加热蒸干,再高温充分灼烧,冷却后所得的固体物质为()
A. Na2SiO3 B. Na2SiO3与Na2CO3
C. SiO2与Na2CO3 D. SiO2、Na2SiO3及Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸的黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)是工业三废之一,其综合利用是一条变废为宝的重要途径。
I.以黄铁矿烧渣为原料制备颜料铁红(Fe2O3)和回收(NH4)2SO4的生产工艺流程如下图:
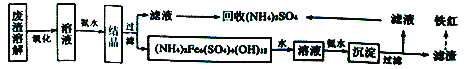
请回答下列问题:
(1)能提高“废渣溶解”速率的措施有______(写出一条即可),“氧化”的目的是______________。 (2)(NH4)2Fe6(SO4)4(OH)12中Fe的化合价是__________________。
(3)该工艺流程图中,第二次加入氨水后,反应的离子方程式为________________________。
II.下图是以黄铁矿烧渣为原料制备颜料铁红的另外一种生产工艺流程:
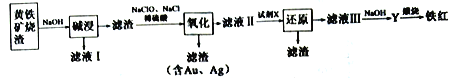
(4)在滤液I中加入廉价的熟石灰,反应的化学方程式是___________________。
(5)“氧化”反应较多,其中FeS 可以看做被水溶液中Cl2氧化,氧化后的溶液中滴加BaCl2有不溶解于盐酸的白色沉淀生成,则水溶液中FeS 与Cl2 反应的离子方程式为________________。
(6)试剂X 为过量铁粉,其作用是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。回答下列问题:
(1)0.3mol NH3分子中所含原子数与__________个H2O分子中所含原子数相等。
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是__________
(3)—定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为__________
(4)某混合盐溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为: 0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO42-) =__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com