
| A. | 卤族元素单质X2(X代表F、Cl、Br、I)均可以与水反应生成HX | |
| B. | 高纯度的硅单质用于制作光导纤维 | |
| C. | 将SO2通入次氯酸钙溶液可得到次氯酸 | |
| D. | 氢氧化铁溶于氢碘酸的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O |
分析 A、氟气和水反应生成氧气和HF;
B、二氧化硅是光导纤维的主要成份;
C、二氧化硫和次氯酸钙发生氧化还原反应生成氯化钙;
D、发生氧化还原反应生成亚铁离子、碘、水;
解答 解:A、Cl、Br、I单质与水反应可表示为 X2+H2O=HX+HXO,氟气和水之间反应生成的是HF和氧气,反应方程式为2F2+2H2O=4HF+O2,故A正确;
B、二氧化硅是光导纤维的主要成份,硅是半导体,故B错误;
C、次氯酸钙具有强氧化性,能将二氧化硫氧化生成硫酸根离子,硫酸根离子和钙离子反应生成微溶物硫酸钙,故C错误;
D、氢氧化铁溶于氢碘酸的离子反应为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故D错误;
故选A.
点评 本题考查元素化合物性质,为高频考点,明确物质性质特殊性是解本题关键,注意氟气和水反应生成氧气、二氧化硫和次氯酸钙反应生成硫酸钙,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11 mol•L-1 | |
| B. | 向BaCl2溶液中加入AgNO3和KI,当两种沉淀共存时,$\frac{c({I}^{-})}{c(C{l}^{-})}$=5.6×10-7 | |
| C. | AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI | |
| D. | AgCl不溶于水,不能转化为AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2的电子式: | B. | Cl原子的结构示意图: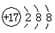 | ||
| C. | HClO分子的结构式:H-Cl-O | D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/(L•s) | B. | 0.012 5 mol/(L•s) | C. | 0.05 mol/(L•s) | D. | 0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
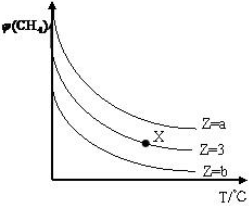 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )| A. | 该反应的焓变△H>0 | |
| B. | 图中Z的大小为b>3>a | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com