
【题目】在某溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38 mol4·L-4,Ksp[Cr(OH)3]=7.0×10-31 mol4·L-4,Ksp[Zn(OH)2]=1.0×10-17 mol3·L-3,Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3。当下列离子以氢氧化物的形式开始沉淀时,所需的pH最小的是( )
A.Fe3+B.Cr3+C.Zn2+D.Mg2+
【答案】A
【解析】
25℃时,Ksp[Fe(OH)3]=4.0×10-38;Ksp[Cr(OH)3]=7.0×10-31,Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11,沉淀时需要的c(OH-)分别为:0.01 mol·L-1的Fe3+:c(OH-)=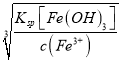 =
=![]() ≈1.587×10-12;0.01 mol·L-1的Cr3+:c(OH-)=
≈1.587×10-12;0.01 mol·L-1的Cr3+:c(OH-)=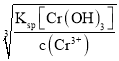 =
=![]() ≈8.8×10-9;0.01 mol·L-1的Zn2+:c(OH-)=
≈8.8×10-9;0.01 mol·L-1的Zn2+:c(OH-)=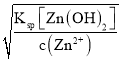 =
=![]() ≈3.2×10-7;0.01 mol·L-1的Mg2+:c(OH-)=
≈3.2×10-7;0.01 mol·L-1的Mg2+:c(OH-)=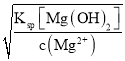 =
=![]() ≈4.24×10-4;c(OH-)越小,沉淀需要的pH越小,故选A。
≈4.24×10-4;c(OH-)越小,沉淀需要的pH越小,故选A。


科目:高中化学 来源: 题型:
【题目】可利用如下反应将二氧化碳转化为甲烷:![]()
![]() kJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂
kJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂![]() Ⅰ、Ⅱ
Ⅰ、Ⅱ![]() 作用下,体积为
作用下,体积为![]() 的密闭容器中,
的密闭容器中,![]() 随光照时间的变化曲线。下列说法正确的是
随光照时间的变化曲线。下列说法正确的是

A.![]() 内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
B.![]() 内,
内,![]() mol/(L·h)
mol/(L·h)
C.a点时,![]() 的转化率相等
的转化率相等
D.反应开始后的![]() 内,第Ⅰ种催化剂的作用下,反应吸收的热量多
内,第Ⅰ种催化剂的作用下,反应吸收的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。
(1)用活性炭还原NO的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
浓度mol/L 时间min | NO | N2 | CO2 |
0 | 10 | 0 | 0 |
10 | 5 | 2.5 | 2.5 |
20 | 2 | 4 | 0.25 |
①在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是____。
②在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正___v逆(填“>”“<”或“=”)。
(2)工业上由N2、H2来制备NH3。不同温度下,向三个相同的容器中投入相同的反应物进行反应,测得不同温度时平衡混合物中NH3的物质的量分数随压强增大而变化如图所示。
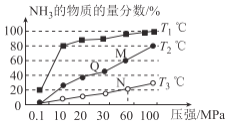
①M点的v正_______Q点的v正(填“>”“<”或“=”)。
②图中三条曲线对应的温度分别为T1、T2、T3,其中温度最高的是____。
③恒温恒容条件下,能说明反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡状态的是____(填选项字母)
2NH3(g)达到平衡状态的是____(填选项字母)
A. 2v(N2)=v(NH3) B.c2(NH3)/[c(N2)c3(H2)]保持不变
C.反应器中的压强不再发生变化 D.3 molH-H键断裂的同时,有2molN-H键断裂
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
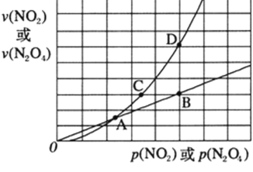
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下4种溶液:①盐酸;②醋酸溶液;③氢氧化钠溶液;④氨水。已知①和②的pH为a,③和④的pH为b,且![]() b
b![]() 。则下列观点错误的是
。则下列观点错误的是
A.若![]() 时,则溶液④中水电离出的
时,则溶液④中水电离出的![]() 等于
等于![]()
B.若将①和③分别加水稀释100倍,则稀释后两溶液的pH之和仍为14
C.若将等体积的②和③分别与足量铝粉反应,生成的氢气后者多
D.若将①和④等体积混合,则混合后的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2+在氨性溶液中和镍试剂(丁二酮肟)反应生成鲜红色的螯合物沉淀,在定性分析中用于鉴定![]() 。该反应可表示为
。该反应可表示为

(1)Ni在元素周期表中的位置是_______,其基态原子的未成对电子数是_______。
(2)与Ni同周期,基态原子最外层电子数为1的元素有________(填元素符号)。其中原子序数最大的元素,其基态原子核外电子排布不符合________(填选项字母)。
A.构造原理 B.泡利不相容原理 C.洪特规则
(3)已知丁二酮肟(物质A)通常情况下是白色粉末,熔点238~240℃,溶于乙醇、乙醚,几乎不溶于水。则丁二酮肟的晶体类型是________。
(4)丁二酮肟的组成元素电负性由大到小的顺序是________。
(5)物质B中含有的微粒间作用力类型有________。
A.离子键 B.共价键 C.氢键 D.配位键
(6)物质B中C原子的杂化方式是________。
(7)氧化镍(NiO)的晶体结构为立方晶系,其晶胞结构与氯化钠相似。氧化镍晶胞中,与一个Ni2+紧邻且距离相等的O2-以线段相连,构成的几何图形为________。
(8)某种氧化镍晶体中存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+取代,晶体仍显电中性。实验测得该氧化镍晶体的化学式为Ni0.90O,其晶胞参数为acm,NA代表阿伏加德罗常数的值,则该晶体的密度为________(用含a和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。
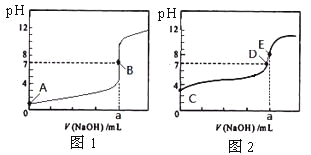
若以HA表示酸,下列说法正确的是
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=C(A-)
C. 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D. 当0 mL<V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)>c(H+) >c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,该反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
2CO(g)+2H2(g)。某温度下,在体积为2L的恒容密闭容器中加入2molCH4、1molCO2以及催化剂进行重整反应,5min时达到平衡,测得CO的浓度为0.5mol/L。
回答下列问题:
(1)0~5min时间内用H2表示的化学反应速率为___mol/(L·min)。
(2)达平衡时CH4的物质的量分数为___,CO2的转化率是___。
(3)反应前后混合气体的压强之比为___。
(4)为了加快反应速率,可采取什么措施___(写两条)。
(5)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | CH4 | CO2 | CO | H2 |
能量/kJ | 1660 | 1490 | 1072 | 436 |
该催化重整反应中反应物的总能量___生成物的总能量(填“大于”或“小于”)。
(6)下列能表示该反应已经达到化学平衡状态的是___。
A.v逆(CH4)=2v正(CO)
B.CO2的浓度保持恒定
C.混合气体平均相对分子质量不变
D.混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图,下列叙述错误的是

A.冰表面第一层中,HCl以分子形式存在
B.冰表面第三层中,冰的氢键网格结构保持不变
C.冰表面各层之间,均存在可逆反应HCl![]() H++Cl
H++Cl
D.冰表面第二层中,H+浓度为5×103 mol·L1(设冰的密度为0.9 g·cm3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com