
【题目】氮的氧化物是造成大气污染的主要物质。
(1)用活性炭还原NO的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10 min和20 min各物质平衡浓度如表所示:
浓度mol/L 时间min | NO | N2 | CO2 |
0 | 10 | 0 | 0 |
10 | 5 | 2.5 | 2.5 |
20 | 2 | 4 | 0.25 |
①在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是____。
②在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正___v逆(填“>”“<”或“=”)。
(2)工业上由N2、H2来制备NH3。不同温度下,向三个相同的容器中投入相同的反应物进行反应,测得不同温度时平衡混合物中NH3的物质的量分数随压强增大而变化如图所示。
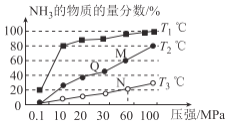
①M点的v正_______Q点的v正(填“>”“<”或“=”)。
②图中三条曲线对应的温度分别为T1、T2、T3,其中温度最高的是____。
③恒温恒容条件下,能说明反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡状态的是____(填选项字母)
2NH3(g)达到平衡状态的是____(填选项字母)
A. 2v(N2)=v(NH3) B.c2(NH3)/[c(N2)c3(H2)]保持不变
C.反应器中的压强不再发生变化 D.3 molH-H键断裂的同时,有2molN-H键断裂
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系 v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
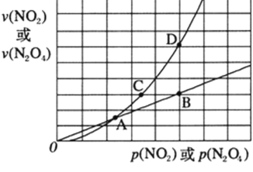
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是______。
【答案】分离出了产物CO2(或减小CO2的浓度) > > T3 BC 2k2·Kp BD
【解析】
(1)②根据浓度商Qc和平衡常数K的关系,判断平衡移动;
(2)①Q、M两点在同一等温曲线上,但M点压强高,根据压强对化学反应速率的影响作答;
②合成氨反应是气体体积减小的放热反应,根据温度对平衡的影响作答;
③反应达到平衡状态时,正逆反应速率相等,平衡时各物质的浓度,百分含量不变,以及由此衍生的一些物理量不变,据此判断;
(3)达到平衡时,正逆反应速率相等,满足平衡条件v(NO2)=2 v(N2O4),即为平衡点。
(1)根据表中数据,10min改变条件后,到20min,重新达到平衡,NO的浓度减少3mol·L-1,N2的浓度增加了1.5mol·L-1,符合化学计量数之比,CO2的浓度理应增加,现在CO2的浓度减少了2.25mol·L-1,说明10min改变的条件是分离出了产物CO2(或减小CO2的浓度);
②根据表中的数据,此温度下,该反应的平衡常数![]() ;20min时,保持温度和容器的体积不变充入NO和N2,浓度增加为原来的两倍,c(NO)=4mol·L-1,c(N2)=8mol·L-1,则此时的浓度商
;20min时,保持温度和容器的体积不变充入NO和N2,浓度增加为原来的两倍,c(NO)=4mol·L-1,c(N2)=8mol·L-1,则此时的浓度商![]() ;Qc小于K,平衡正向移动,则v正>v逆;
;Qc小于K,平衡正向移动,则v正>v逆;
(2) 合成氨反应为N2(g)+3H2(g)![]() 2NH3(g)△H<0;
2NH3(g)△H<0;
①Q、M两点在同一等温曲线上,但是M点压强高;其他条件一定时,压强越大,化学反应速率越大,因此M点的正反应速率大,则M点的v正>Q点的v正
②合成氨反应是正向气体体积减小的放热反应,其他条件一定时,温度升高能使化学平衡逆向移动,则NH3的含量越小,根据图像可知,T1、T2、T3中温度最高的是T3;
③A.2v(N2)=v(NH3),不能说明正反应速率等于逆反应速率,因此不能判断该反应是否达到平衡,A不符合题意;
B.![]() 是该反应的化学平衡常数的表达式,其值不变,说明该反应达到了最大限度,故反应达到了平衡,B符合题意;
是该反应的化学平衡常数的表达式,其值不变,说明该反应达到了最大限度,故反应达到了平衡,B符合题意;
C.在恒温恒容条件下,气体的压强之比等于其物质的量之比,合成氨反应正反应是气体分子数减小的反应,若压强不变,说明气体的物质的量不变,反应达到平衡,C符合题意;
D.H-H键断开表示的是正反应速率,N-H键断裂表示逆反应速率;若反应达到平衡,断开3molH-H键的同时,应该有6molN-H键断裂,现只有2molN-H键断裂,说明反应未达到平衡,D不符合题意;
答案选BC;
(3)NO2的消耗速率表示的是正反应速率;N2O4的消耗速率表示的是逆反应速率;当反应达到平衡时,正逆反应速率相等,用不同的物质表示时,其数值之比等于计量数之比,则v(NO2)=2v(N2O4);根据关系式,有 k1·p2(NO2)= 2k2·p(N2O4),![]() ,该反应的平衡常数
,该反应的平衡常数![]() ,联立两式,可得k1=2k2·Kp;
,联立两式,可得k1=2k2·Kp;
达到平衡时,v(NO2)=2v(N2O4),B、D两点表示的速率恰好满足,因此达到平衡的点为BD。


科目:高中化学 来源: 题型:
【题目】T℃时,在容积均为0.5L的两个密闭容器中发生:2A(g)+B(g)2C(g)△H=﹣Q kJ/mol (Q>0),6min后,容器①中反应达平衡,有关数据如下表,下列叙述中正确的是
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L·min)
B. ②中达平衡时放出的热量为0.05QkJ
C. 其他条件不变,若容器②保持绝热恒容,则达到平衡时C的体积分数小于2/3
D. 若①达平衡后,再通入1molA与0.5molB,再达平衡时A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在水中的电离方程式为:
在水中的电离方程式为:![]() 。某温度下,向
。某温度下,向![]() 的蒸馏水中加入
的蒸馏水中加入![]() 晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
A.该溶液中![]() 浓度为
浓度为![]()
B.由水电离出来的![]() 的浓度是
的浓度是![]()
C.加入的![]() 的物质的量为
的物质的量为![]()
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL1mol/LNH2OH![]() 溶液中加水进行稀释,所得曲线如图所示V表示溶液的体积
溶液中加水进行稀释,所得曲线如图所示V表示溶液的体积![]() ,
,![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()

A.![]() 的电离平衡常数Kb的数量级为
的电离平衡常数Kb的数量级为![]()
B.用![]() 的盐酸滴定10ml1mol/LNH2OH溶液至
的盐酸滴定10ml1mol/LNH2OH溶液至![]() ,消耗盐酸体积小于10mL
,消耗盐酸体积小于10mL
C.当溶液稀释至![]() 时,溶液中由水电离出的
时,溶液中由水电离出的![]()
D.![]() 溶液中离子浓度大小关系:
溶液中离子浓度大小关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,请根据实验室和工业上制氢及氢气性质回答相关问题。
I.实验室用稀硫酸与锌粒(黄豆粒大小)制取氢气时加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)少量硫酸铜溶液可以加快氢气生成速率的原因是______________;
(2)要加快上述实验中产生氢气的速率,还可采取的措施有______、_______(列举两种措施)。
(3)当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因____________。
II.工业上海水制氢气的新技术:2H2O![]() 2H2↑+O2↑。试回答下列问题:
2H2↑+O2↑。试回答下列问题:
(1)分解海水的反应属于_____反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属化合物陶瓷作电解质,两极上发生的电极反应分别为:A极是2H2+2O2-―4e-=2H2O,B极是O2+4e-=2O2-,则A极是电池的____极。
(3)氢气的储存比较困难,最近科学家研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2![]() HCOONa+H2O。下列有关说法正确的是____。
HCOONa+H2O。下列有关说法正确的是____。
A 储氢释氢过程均无能量变化 B 该反应属于可逆反应
C 储氢过程中,NaHCO3被还原 D 释氢过程中,每消耗0.1 mol H2O放出2.24 L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:现有两个体积相等的恒容密闭容器,向甲容器中加入1molA和1 molB,乙容器中加入1molX和3molY,两容器中分别发生下列两个反应,反应开始时甲、乙两容器的反应条件相同。

回答下列问题:
(1)反应达到平衡时,甲、乙两容器中平均反应速率v(A)与v(X)的大小关系是___。(填序号)。
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.无法比较
(2)甲中反应达到平衡后,若给甲容器升温,正反应速率将___(填“增大”、“减小”或“不变”)。
(3)表示乙中反应达到平衡的标志是___(填序号)。
①X、Y、Z的物质的量之比为1:3:2
②X、Y、Z的浓度不再发生变化
③容器中的温度不再发生变化
④3v正(Y)=2v逆(Z)
Ⅱ:工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ·mol1
CO2(g)+H2(g) △H=-41kJ·mol1
某化学兴趣小组同学研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
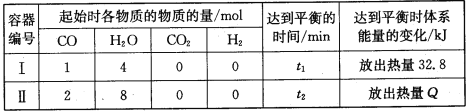
(1)容器Ⅰ中反应达到平衡时,CO的转化率为___。
(2)容器Ⅱ中反应的平衡常数K=___。
(3)下列叙述正确的是___(填字母)。
a.平衡时,两容器中H2 的体积分数相等
b.容器Ⅱ反应达到平衡状态时,Q>65.6
c.反应开始时,两容器中反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中SO2最大使用量为0.25g·L1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol·L-1NaOH标准溶液进行滴定。
(1)滴定前排气泡时,应选择图中的___(填序号)。


(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
a.=10mL b.=40mL c.<10 mL d.>40mL
(3)上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:___。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为___g·L1。滴定终点读数时俯视刻度线,则测量结果比实际值___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38 mol4·L-4,Ksp[Cr(OH)3]=7.0×10-31 mol4·L-4,Ksp[Zn(OH)2]=1.0×10-17 mol3·L-3,Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3。当下列离子以氢氧化物的形式开始沉淀时,所需的pH最小的是( )
A.Fe3+B.Cr3+C.Zn2+D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是

A.甲烷的燃烧热△H=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)=CO(g)+2H2O(g) ΔH=-890.3kJ·mol-1
O2(g)=CO(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水所放出的热量少
C.根据右图金刚石在一定条件下转化成石墨提供的信息,可知生成物比反应物稳定,向外界放出的热量为E2 -E3
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com