
分析 (1)pH=-lgc(H+),pH=2的H2SO4稀释100倍,c(H+)由0.01mol/L变为0.0001mol/L;pH=12的NaOH,根据c(OH-)=$\frac{1×1{0}^{-14}}{C({H}^{+})}$计算出氢氧根离子浓度为0.01mol/L,氢氧根离子浓度为0.01mol/L稀释100倍,变为0.0001mol/L,再根据pH=-lgc(H+)计算出溶液的pH;
(2)依据pH=-lgc(H+),计算PH=5的硫酸溶液中,氢离子的物质的量浓度,依据H2SO4=2H++SO42-,计算硫酸根离子的浓度;溶液稀释10倍后,氢离子浓度由1×10-5mol/L变为1×10-6mol/L,稀释100倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中硫酸根的物质的量不变,计算稀释后溶液中硫酸根的物质的量浓度,据此计算解答.
解答 解:(1)pH=-lgc(H+),pH=2的H2SO4c(H+)=0.01mol/L,加水稀释100倍,溶液中氢离子浓度c(H+)由0.01mol/L变为0.0001mol/L,则稀释后溶液的pH=-lg0.0001=4,
pH=12的NaOH中c(H+)=10-12mol/L,c(OH-)=$\frac{1×1{0}^{-14}}{C({H}^{+})}$=0.01mol/L,NaOH稀释100倍,溶液中氢离子浓度c(OH-)由0.01mol/L变为0.0001mol/L,c(H+)=$\frac{1×1{0}^{-14}}{C(O{H}^{-})}$=10-10mol/L,pH=-lg10-10=10,
故答案为:=;=;
(2)由pH=-lgc(H+),可知PH=5的硫酸溶液中c(H+)=1×10-5mol/L,硫酸为强电解质完全电离,氢离子浓度为硫酸根离子浓度2倍,所以c(SO42-)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×1×10-5mol/L=5×10-6mol/L;
溶液稀释10倍后,氢离子浓度由1×10-5mol/L变为1×10-6mol/L,硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×$\frac{1}{10}$=5×10-7mol/L,
稀释后溶液中H+离子浓度与SO42-离子浓度比值约为:1×10-6mol/L:5×10-7mol/L:=2:1,
溶液稀释100倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L;硫酸根离子浓度为:c(SO42-)=5×10-7mol/L×$\frac{1}{100}$=5×10-9mol/L,
稀释后溶液中H+离子浓度与SO42-离子浓度比值约为:1×10-7mol/L:5×10-9mol/L:=20:1,
故答案为:2:1;20:1.
点评 本题考查了有关pH值计算以及溶液的稀释,注意掌握溶液酸碱性与溶液pH的关系,溶液稀释过程中pH值变化的规律是解题关键,注意酸碱稀释接近中性应考虑水的电离,题目难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
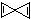 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| B. | NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,混合溶液中:c(Na+)<c(CH3COO-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=$\frac{1}{2}$c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第1组反应的其余产物只有H2O | |
| B. | 第2组反应中Cl2与FeBr2的物质的量之比可能等于1:2 | |
| C. | 第3组反应中生成22.4L,一定转移电子2mol | |
| D. | 氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
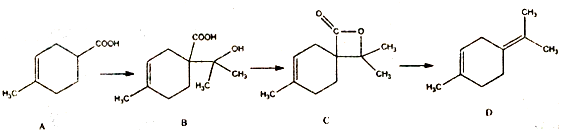
| A. | 1mol有机物B分别于足量的Na和Na2CO3溶液反应,分别生成lmolH2 和lmolCO2 | |
| B. | 有机物B的分子式为C11H18O3,它能发生取代、加成和消去反应 | |
| C. | 有机物c所有同分异构体中不可能有芳香族化合物存在 | |
| D. | 有机物D分子中所有碳原子一定共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 Na2SO4溶液中含有0.4NA个Na | |
| B. | 在标准状况下,NA个C02分子与NA个H2SO4分子所占的体积之比为1:1 | |
| C. | 5.6g铁在足量氯气中燃烧时失去的电子数目为0.2NA | |
| D. | 常温常压下,64g SO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
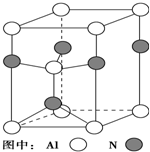 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、氮化硼、磷化硼和砷化镓属于此列,如氮化铝晶体晶胞如右图所示
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、氮化硼、磷化硼和砷化镓属于此列,如氮化铝晶体晶胞如右图所示
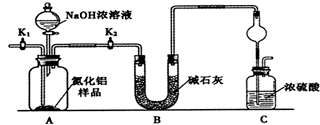
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com