
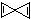 .
. 分析 (1)先确定该有机物的实验式,再根据相对分子质量确定分子式;
(2)根据浓硫酸和碱石灰增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而确定其实验式;
(3)根据X的分子式及“红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别”确定X的结构简式.
解答 解:(1)根据①②可以确定氧元素的质量分数,进一步可以确定该有机物的实验式,由④可以确定有机物分子的相对分子质量.综上所述,最终可以确定有机物的分子式的最佳组合为:①②④,
故答案为:①②④;
(2)浓硫酸增重可知水的质量为7.2g,则水的物质的量为:n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,n(H)=0.8mol,m(H)=0.8g;碱石灰增重13.2g,可知二氧化碳质量为13.2g,则:n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,m(C)=3.6g,
由于m(C)+m(H)=4.4g,有机物的质量为6g,所以有机物中氧的质量为:1.6g,n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
所以:n(C):n(H):n(O)=0.3mol:0.8mol:0.1mol=3:8:1,
则该有机物的实验式为:C3H8O,
故答案为:C3H8O;
(3)X的分子式为C5H4,其不饱和度为:$\frac{5×2+2-4}{2}$=4;红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,说明其分子中所有的H原子都是等效的,则X具有对称结构,结合不饱和度为4可知X的结构简式为: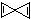 ,
,
故答案为: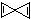 .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用.


 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COOCH2CH3+H2O $\stackrel{催化剂△}{→}$ CH3CH2OH+CH3COOH | |
| B. | CH2=CH2+HCl$→_{△}^{一定条件}$CH3CH2Cl | |
| C. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.57 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.61 | 1.8 | 2.1 | 2.5 | 3.0 |
 ,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)
,其中S-N中,你认为共用电子对偏向谁?氮(写原子名称)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第VIIA族元素由上至下其单质的沸点依次升高 | |
| B. | 第VIA族元素的最高化合价都为+6价 | |
| C. | 离核越远的电子层上的电子能量越低 | |
| D. | 所有元素的原子中都含有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | KNO3(NaCl) | H2O | 重结晶 |
| B | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| C | 乙醇(水) | 生石灰 | 蒸馏 |
| D | 溴苯(溴) | H2O | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 118号元素属于第八周期元素 | |
| B. | 118号元素是一种金属元素 | |
| C. | 118号元素的原子核中含有118个质子 | |
| D. | 118号元素原子经化学反应后可转化成其他元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com