
|
能使H2O+H2O | |
A. |
在水中加入NaHCO3 |
B. |
在水中加入CuCl2 |
C. |
在水中加入稀硫酸 |
D. |
将水加热到99℃(其中c(H+)=10-6 mol/L) |
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
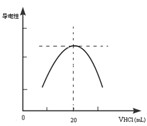 某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第8期 总第164期 人教课标版(选修4) 题型:058
有
A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按如图所示安装装置,在电路中连接密闭开关K后,测得各支路电流强度IⅠ≈IⅡ(其中IⅡ略小).若撤去B,测得IA回答下列问题:
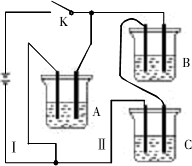
(1)通过实验,请你推断A、B、C三种溶液溶质的化学式分别为:A:________,B:________,C:________.
(2)若向C溶液中滴入酚酞呈红色,则C是________.
(3)已知:H2O![]() H++OH-,根据上述实验,请你判断,若将A、B、C分别等体积进行两两混合,能使H2O的电离程度最大的组合为________(填“AB”、“BC”或“AC”).试用离子方程式解释其原因________.
H++OH-,根据上述实验,请你判断,若将A、B、C分别等体积进行两两混合,能使H2O的电离程度最大的组合为________(填“AB”、“BC”或“AC”).试用离子方程式解释其原因________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com