
����Ŀ����֪A��B��C��D���ֶ�����Ԫ��,���ǵĺ˵������������Aԭ�ӡ�Cԭ�ӵ�L�ܲ��ж�������δ�ɶԵĵ���,C��Dͬ���塣E��F���ǵ�4����Ԫ��,Eԭ�Ӻ�����4��δ�ɶԵ���,Fԭ�ӳ������ܲ�ֻ��1��������,������ܲ��Ϊȫ����������������Ϣ��գ�
(1)��̬Dԭ����,����ռ�ݵ�����ܲ������________,
���ܲ���е�ԭ�ӹ����Ϊ________��
(2)E2+�ļ۲�����Ų�ͼ��________,
Fԭ�ӵĺ�������Ų�ʽ��________��
(3)AԪ�ص�����������Ӧ��ˮ��������ԭ�Ӳ�ȡ�Ĺ���ӻ���ʽΪ________,
BԪ�ص���̬�⻯��ķ���ģ��Ϊ________��
(4)������AC2��B2C��������DAB-��Ϊ�ȵ�����,���ǽṹ����,DAB-�ĵ���ʽΪ________��
(5)ij�ֻ�������D��E��F����Ԫ�����,�侧����ͼ��ʾ,���仯ѧʽΪ________,�þ������µ���Ϊ������,��������洹ֱ,����ͼ����ʾ��������ʽ����þ�����ܶȣ�d=________g��cm-3��

���𰸡�(1)M 9 (2)![]() 1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
(3)sp2 ������ (4) ![]()
(5)CuFeS2 [![]() ��4]��[(524��10-10cm)2��(1 030��10-10)cm]=4.32
��4]��[(524��10-10cm)2��(1 030��10-10)cm]=4.32
��������A��B��C��D���ֶ�����Ԫ��,���ǵĺ˵������������,Aԭ�ӡ�Cԭ�ӵ�L�ܲ��ж�������δ�ɶԵĵ���,��Aԭ�Ӻ�������Ų�ʽΪ1s22s22p2, Cԭ�Ӻ�������Ų�ʽΪ1s22s22p4,��AΪ̼Ԫ�ء�CΪ��Ԫ��;Bԭ����������C��O֮��,��BΪ��Ԫ��;C��Dͬ����,��DΪ��Ԫ��;E��F���ǵ�4����Ԫ��,Eԭ�Ӻ�����4��δ�ɶԵ���,ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d64s2,��EΪFe;Fԭ�ӳ������ܲ�ֻ��1��������,������ܲ��Ϊȫ����,Fԭ�Ӻ��������=2+8+18+1=29,��FΪͭԪ�ء�
(1)��̬��ԭ���е���ռ�ݵ�����ܲ�Ϊ��3�ܲ�,����ΪM,���ܲ���1��s�����3��p�����5��d���,����9��ԭ�ӹ����
(2)Fe2+�ļ۲�����Ų�ʽΪ3d6,��۲�����Ų�ͼ��![]() ,FΪͭԪ��,ԭ�Ӻ�����29������,ԭ�ӵĺ�������Ų�ʽ��1s22s22p63s23p63d104s1��
,FΪͭԪ��,ԭ�Ӻ�����29������,ԭ�ӵĺ�������Ų�ʽ��1s22s22p63s23p63d104s1��
(3)̼Ԫ�ص�����������Ӧ��ˮ����ΪH2CO3,���ӽṹʽΪ![]() ,����̼ԭ�ӳ�3���Ҽ���û�йµ��Ӷ�,̼ԭ�Ӳ�ȡsp2�ӻ���ʽ;B����̬�⻯��ΪNH3,Ϊ�����νṹ��
,����̼ԭ�ӳ�3���Ҽ���û�йµ��Ӷ�,̼ԭ�Ӳ�ȡsp2�ӻ���ʽ;B����̬�⻯��ΪNH3,Ϊ�����νṹ��
(4)������CO2��N2O��������SCN-��Ϊ�ȵ�����,���ǽṹ����,SCN-��̼ԭ������ԭ��֮��ֱ��γ�2�Թ��õ��Ӷ�,SCN-�ĵ���ʽΪ![]()
(5)������D(S)ԭ��λ�ھ����ڲ�,ԭ����ĿΪ8��,E(Fe)ԭ��6��λ�����ϡ�4��λ������,E(Fe)ԭ����Ŀ=6��![]() +4��
+4��![]() =4,F(Cu)ԭ��4��λ�����ϡ�1��λ���ڲ���8��λ�ڶ�����,ԭ����Ŀ=4��
=4,F(Cu)ԭ��4��λ�����ϡ�1��λ���ڲ���8��λ�ڶ�����,ԭ����Ŀ=4��![]() +1+8��
+1+8��![]() =4,������ͭ��������ԭ����Ŀ֮��=4��4��8=1��1��2,�ʸþ��廯ѧʽΪCuFeS2;��������=
=4,������ͭ��������ԭ����Ŀ֮��=4��4��8=1��1��2,�ʸþ��廯ѧʽΪCuFeS2;��������=![]() ��4,�������=(524��10-10cm)2��(1 030��10-10)cm,�þ�����ܶ�d=
��4,�������=(524��10-10cm)2��(1 030��10-10)cm,�þ�����ܶ�d=
[![]() ��4]��[(524��10-10cm)2��(1 030��10-10)cm]=4.32 g��cm-3��
��4]��[(524��10-10cm)2��(1 030��10-10)cm]=4.32 g��cm-3��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʵ�����������õ���Ⱥ͵���ƽ�ⳣ����ʾ���±��dz����¼���������ʵĵ���ƽ�ⳣ����
���� | ���볣��(Ka��Kb) | �ѣ������� | �ܶȻ�������Ksp�� |
CH3COOH | 1��8��10��5 | BaSO4 | 1��10-10 |
HNO2 | 4��6��10��4 | BaCO3 | 2.6��10-9 |
HCN | 5��10��10 | CaSO4 | 7��10-5 |
HClO | 3��10��8 | CaCO3 | 5��10-9 |
NH3��H2O | 1��8��10��5 |
��ش��������⣺
��1�������������У�������������_____________ (�û�ѧʽ��ʾ)��������ʹ������Һ��CH3COOH�ĵ���̶��������볣������IJ�����________________(�����)��
A�������¶� B����ˮϡ��
C����������CH3COONa���� D��������������
��2��CH3COONH4��ˮ��Һ��________ (ѡ����������������������������)��������__________________����Һ�и�����Ũ�ȴ�С�Ĺ�ϵ��_____________________��
��3�����ʵ���1��1��NaCN��HCN�Ļ����Һ����pH��7������Һ�����ӵ�Ũ�ȴӴ�С����Ϊ_____________________________________��
��4����ҵ�г���BaSO4ת��ΪBaCO3���ٽ����Ƴɸ��ֿ����Եı��Σ��磺BaCl2���������������ñ��͵Ĵ�����Һ����BaSO4��ĩ�������ϲ��䴿����BaSO4ת��ΪBaCO3������������BaSO4����Һ���ڸ�����Һ�мӴ����ĩ�����Ͻ��裬ΪʹSO42-���ʵ���Ũ�ȴﵽ0.0lmol��L-1���ϣ�����Һ��CO32-���ʵ���Ũ��Ӧ ��____________mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������֬����( )
������ ������ ��ú�� ������ �������� ��ʯ��
A.�٢� B.�ܢ� C.�٢� D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NASA������һ�������������ε�ء��õ�طŵ�ʱ����ԭ������ͼ��ʾ����ط�ӦΪ��2Fe��O2��2H2O===2Fe(OH)2��
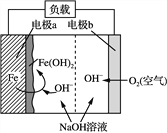
�йظõ�طŵ�ʱ��˵����ȷ����(����)
A. a����������
B. b��Ϊ��ظ���
C. ������a������������b��
D. �ɵ���ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����
A. �Ҵ��Ľṹ��ʽΪC2H6O B. C4H2C18��5��ͬ���칹��
C. ������Ե��룬�������ӻ����� D. ����ϩ����������ԭ�ӿ��ܹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2�������Ƿ���SO2��HCl����������ʵ�飺
�ٽ�����ͨ���ữ��AgNO3��Һ�У�������ɫ����a��
����ȥ����a������Һ�м���Ba��NO3��2��Һ��������ɫ����b��
����˵����ȷ���ǣ� ��
A.����aΪAgCl
B.����bΪBaCO3
C.�������SO2
D.������û��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����þ��й���ǰ����
��1����ͼ�ǴӺ�ˮ����ȡþ�ļ����̣�
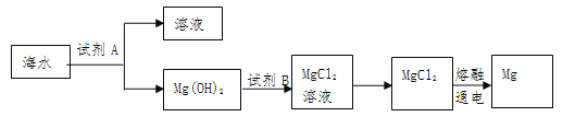
��Mg(OH)2ת��ΪMgCl2�����ӷ���ʽ��_______________��
�ڽ�MgCl2��Һ��________��������������ȴ���ᾧ�Ƶ�MgCl2���塣
������ˮMgCl2��ȡMg�Ļ�ѧ����ʽ��________________________��
��2���������и�����I����ʽ���ڵĵ�Ԫ�ء�ʵ������ȡI2��;��������ʾ��

�����պ������ҽ�ʱ���õ���Ҫ����������________________��
�����ữ����Һ�мӹ���������Һ��д���÷�Ӧ�����ӷ���ʽ��_____________________��
�۷�Ӧ�����ɼ���_________����ȡ����������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں���ʱ����1L�̶��ݻ��������г���0.1mol NO2��������Ӧ2NO2(g)![]() N2O4(g)������������˵���÷�Ӧ�ﵽƽ��״̬����
N2O4(g)������������˵���÷�Ӧ�ﵽƽ��״̬����
A. V(NO2)=2V(N2O4) B. �����ڵ�ѹǿ����ʱ
C. ������c(NO2)=c(N2O4)ʱ D. ��������������������ֲ���ʱ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com