
【题目】在恒温时,向1L固定容积的容器中充入0.1mol NO2,发生反应2NO2(g)![]() N2O4(g),下列叙述能说明该反应达到平衡状态的是
N2O4(g),下列叙述能说明该反应达到平衡状态的是
A. V(NO2)=2V(N2O4) B. 容器内的压强不变时
C. 容器中c(NO2)=c(N2O4)时 D. 容器中气体的总质量保持不变时
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第4周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号是________,
该能层具有的原子轨道数为________。
(2)E2+的价层电子排布图是________,
F原子的核外电子排布式是________。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为________,
B元素的气态氢化物的分子模型为________。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为________。
(5)某种化合物由D、E、F三种元素组成,其晶胞如图所示,则其化学式为________,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:d=________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B. 100mL 2molL-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中,不能用同一个离子方程式表示的是( )
A.盐酸分别与氢氧化钠溶液、澄清石灰水反应
B.硫酸分别与氢氧化钠溶液、氢氧化钡溶液反应
C.硝酸分别与碳酸钠溶液、碳酸钾溶液反应
D.锌分别与稀盐酸、稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用四氯化碳萃取碘的饱和水溶液中的碘,下列说法不正确的是
A.实验使用的仪器是分液漏斗
B.碘在四氯化碳中的溶解度比在水中的溶解度大
C.碘的四氯化碳溶液呈紫红色
D.分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、氮化镓及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。
Zn2+基态核外电子排布式为______________,其核外存在______________对自旋相反的电子。
写出两个与水分子具有相同空间构型的分子和阴离子:__________,____________。
水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________(填序号)。
A、氧原子的杂化类型发生了改变 B、微粒的空间构型发生了改变
C、微粒的化学性质发生了改变 D、微粒中的键角发生了改变
在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图甲),已知冰的升华热是+51kJ![]() mol-1,除氢键外,水分子间还存在范德华力(11kJ
mol-1,除氢键外,水分子间还存在范德华力(11kJ![]() mol-1),则冰晶体中氢键的键能是___________kJ
mol-1),则冰晶体中氢键的键能是___________kJ![]() mol-1。
mol-1。
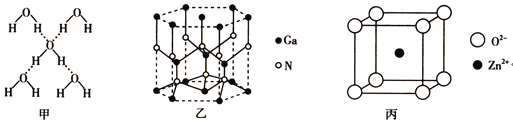
氮化镓的晶体结构如图乙所示,其中氮原子的杂化轨道类型是______________;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是______________;该晶体的化学式为______________。金刚砂(SiC)和氮化镓并称为第三代半导体材料的双雄,它与金刚石具有相似的晶体结构,试比较金刚石和金刚砂的熔点高低,并说明理由:__________________________。
某种ZnO晶体的晶胞如图丙所示,Zn2+的配位数为_______________,其晶胞中Zn2+和O2-之间的距离为apm,列式表示该晶体的密度:____________g![]() cm-3(不必计算结果)。
cm-3(不必计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______________________(写出元素符号),②号元素基态原子的电子排布图为________。
(2)①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的立体构型为________。②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是_______________________________。
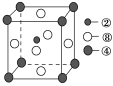
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子
b.该分子含有4个σ键和1个π键
c.该分子中的②号原子采取sp2杂化
d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_________________________。
(5)若元素⑤与Fe元素形成的某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g·cm-3。
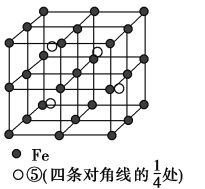
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A. 0.1mol/L的盐酸和0.1mol/L的氨水溶液
B. 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
C. pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D. pH=4的盐酸和pH=l0的氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com