
【题目】某同学实验报告中有以下数据,其中数据不合理的是( )
A. 用托盘天平称取11.5g食盐
B. 用量筒量取12.4mL盐酸
C. 用广泛pH试纸测得某溶液的pH值为3.6
D. 用标准NaOH溶液滴定未知浓度的盐酸,用去21.20mLNaOH溶液
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。
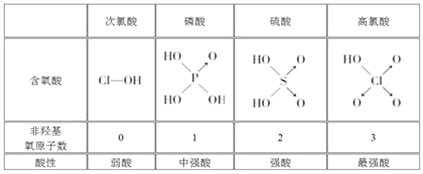
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:亚磷酸______________________,亚砷酸________________________。
(2)亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式分别是:
亚磷酸:______________________________________,
亚砷酸:_______________________________________。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,写出化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
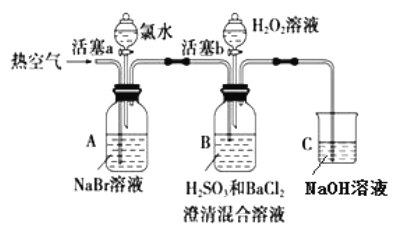
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列装置可以完成的实验组合是
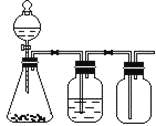
选项 | 制气装置 | 洗气瓶中试剂 | 瓶中气体 |
A | 氯酸钾 MnO2 | 浓硫酸 | O2 |
B | 石灰石 稀盐酸 | NaHCO3溶液 | CO2 |
C | Zn 稀硫酸 | 浓硫酸 | H2 |
D | MnO2 浓盐酸 | 浓硫酸 | Cl2 |
A. AB. BC. CD. D
【答案】B
【解析】
A. 二氧化锰与氯酸钾制取氧气,属于固体加热型,锥形瓶没有加热,所以不能用图中实验装置制取,选项A错误;
B.大理石与盐酸生成二氧化碳气体,属于固液常温型,盐酸有挥发性,挥发的HCl能与碳酸氢钠溶液反应产生二氧化碳气体,且二氧化碳密度比空气的大,能用向上排空气法收集;选项B正确。
C.锌粒与稀硫酸反应生成氢气,属于固液常温型,但氢气密度比空气的小,不能用向下排空气法收集,选项C错误;
D. 二氧化锰与浓盐酸制取氯气,属于固体加热型,锥形瓶没有加热,所以不能用图中实验装置制取,选项D错误;
故合理选项是B。
【题型】单选题
【结束】
20
【题目】下列物质中,不可作漂白剂的是( )
A. SO2 B. Ca(ClO)2 C. Na2SiO3 D. NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用X射线激光技术观察容器中某反应,各气态反应物粒子在催化剂表面形成化学键过程的示意图如下图所示。下列关于此反应说法错误的是
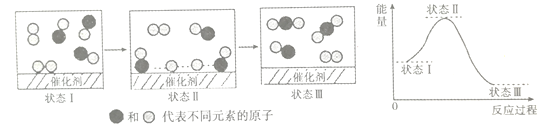
A. 该反应既是化合反应,也是氧化还原反应
B. 该反应是可逆反应,若升高温度,反应物平衡转化率降低
C. 一定条件下达到平衡后,若增大压强,则v(正)、v(逆)均增大,且v(正)>v(逆)
D. 该示意图表明反应物粒子先须断裂所有旧化学键,然后形成新化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是
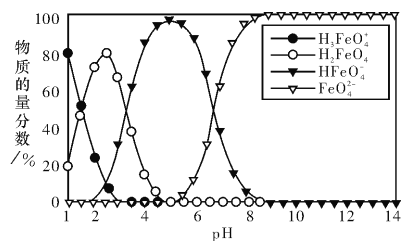
A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中![]()
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G常用于有机合成和药物制造,一种合成G的路线如下,请回答相关问题。
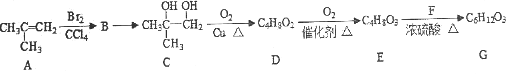
已知:①RCH2Br![]() RCH2OH;
RCH2OH;
②RCHO![]() RCOOH;
RCOOH;
③G分子中含有羟基。
(1)请用系统命名法给A命名_________________。
(2)A→B反应类型为__________。B→C反应试剂和反应条件是_______________。
(3)D分子中官能团名称为___________________。
(4)C→D反应的化学反应方程式为________________________________________。
(5)E→G反应的化学反应方程式为________________________________________。
(6)满足下列条件的E的同分异构体还有______种(不包括E),其中核磁共振氢谱中有四组峰,面积比为3:3:1:1的同分异构体的结构简式为_____________。
①与碳酸钠溶液反应有气体产生,②分子中无![]() 结构。
结构。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com