
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
【答案】 正 Pb+SO42--2e-=PbSO4 增大 32 阳 4OH――4e-=2H2O+O2↑ CuO
【解析】电解中发现Ag电极有气体产生,则Ag电极上发生2H++2e-=H2↑,则Ag电极为阳极,因此A为负极,B为正极。甲池中铁电极为阳极,Fe-2 e-=Fe2+;乙池中锌为阴极,Cu2++2 e-=Cu,C为阳极,4OH――4e-=2H2O+O2↑。
(1)根据上述分析,B是铅蓄电池的正极,A为负极,放电过程中A电极反应式为Pb+SO42--2e-=PbSO4,故答案为:正;Pb+SO42--2e-=PbSO4;
(2)甲池中用铁作阳极电解稀硫酸,电极反应分别为2H++2e-=H2↑,Fe-2 e-=Fe2+,电解后甲池中硫酸的浓度减小,溶液的酸性减弱,电解液的pH增大;标准状况下11.2L的氢气的物质的量为0.5mol,转移电子1mol;根据电路中转移的电子守恒,Zn电极析出0.5molCu,质量为32g,故答案为:增大;32;
(3)根据上述分析,乙池中 C(碳)电极是阳极。C电极的电极反应式为4OH――4e-=2H2O+O2↑,锌为阴极,Cu2++2 e-=Cu,反应一段时间后,溶液中减少的元素有铜和氧,要使CuSO4溶液恢复到原浓度,需要向乙池中加入一定量的氧化铜固体或碳酸铜固体,故答案为:阳;4OH――4e-=2H2O+O2↑;CuO。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
A.1:2
B.2:1
C.1:1
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
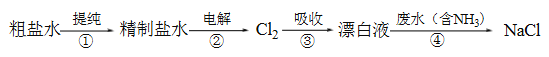
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+3Y(g)=2Z(g),在某段时间内X的化学反应速率为lmol/(L·min),则此段时间内Z的反应速率为
A. 0.5mol/(L·min) B. 2mol/(L·min)
C. 1mol/(L·min) D. 3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
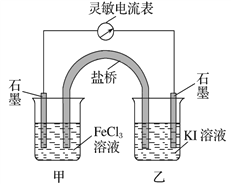
A. 反应时,电子从乙中石墨电极沿导线流向甲中石墨电极
B. 反应时,甲中石墨电极发生还原反应
C. 电流表读数为零时,反应达到化学平衡状态
D. 电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图所示。下列有关说法不正确的是
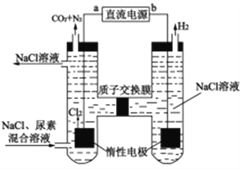
A. a为直流电源的正极
B. 阳极室中发生的电极反应式有2Cl--2e-=Cl2↑
C. 电解结束后,阴极室溶液的pH将降低
D. 若两极共收集到气体13.44L(标准状况),混合溶液可除去尿素7.2g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是
A. Al3+、Na+、HCO3-、[Al(OH)4]-
B. Ca2+、HCO3-、Cl-、K+
C. Fe3+、H+、SO42-、S2-
D. Fe2+、NO3-、Na+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氢氧化钠溶液、铁屑、稀硫酸等试剂制备氢氧化亚铁沉淀,其装置如图所示。
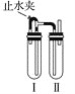
(1)在试管Ⅰ里加入的试剂是____________________。
(2)在试管Ⅱ里加入的试剂是____________________。
(3)为了制得白色氢氧化亚铁沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______________________________________。
(4)这样生成的氢氧化亚铁沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将海水晒制后过滤可得到粗制食盐和母液,氯碱厂以电解饱和食盐水制取NaOH的工艺流程示意图如下:
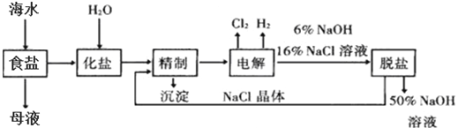
(1)在电解过程中,Cl2在与电源_______(填“正”或“负”)极相连的电极上生成;
(2)精制过程为除去溶液中的少量Ca2+、Mg2+、SO42-,加入试剂顺序合理的是_____________;
a.先加NaOH,再加Na2CO3,再加BaCl2
b.先加NaOH,后加Ba(OH)2,再加Na2CO3
c.先加BaCl2,后加NaOH,再加Na2CO3
(3)脱盐工序中利用NaOH(溶解度随温度变化较大)和NaCl(溶解度随温度变化较小)在溶解度上的差异,通过______________________________________,然后趁热过滤分离NaCl晶体,并得到50%的NaOH溶液(填写设计方案,无需计算具体数据);
(4)写出电解饱和食盐水的反应方程式_____________;
如果在实验室中电解200ml饱和食盐水,一段时间后电源负极连接的电极处收集到224ml气体(已换算成标况),此时溶液中NaOH的物质的量浓度为__________mol·L-1(不考虑生成气体的溶解与反应,以及溶液体积的变化);
(5)分离出NaCl后的母液经过下列流程可以制取溴:
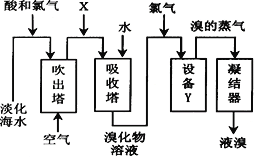
①若物质X是SO2,那么在这一环节中体现SO2_____________(填“氧化性”或“还原性”);
②若物质X是Na2CO3,则需要把氯气换成硫酸,此时吸收塔中发生的反应Br2+Na2CO3=NaBrO3+CO2+NaBr,配平该反应_____________。若有48 g溴完全反应,转移电子的物质的量为_____________ mol;
③在吹出塔中通入热空气或水蒸气吹出Br2,利用了溴的(填序号)_____________;
a.氧化性b.还原性c.挥发性d.腐蚀性
④设备Y在实验室中可以通过酒精灯、温度计、_____________等玻璃仪器组成的装置实现。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com