
【题目】将海水晒制后过滤可得到粗制食盐和母液,氯碱厂以电解饱和食盐水制取NaOH的工艺流程示意图如下:
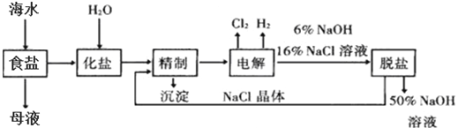
(1)在电解过程中,Cl2在与电源_______(填“正”或“负”)极相连的电极上生成;
(2)精制过程为除去溶液中的少量Ca2+、Mg2+、SO42-,加入试剂顺序合理的是_____________;
a.先加NaOH,再加Na2CO3,再加BaCl2
b.先加NaOH,后加Ba(OH)2,再加Na2CO3
c.先加BaCl2,后加NaOH,再加Na2CO3
(3)脱盐工序中利用NaOH(溶解度随温度变化较大)和NaCl(溶解度随温度变化较小)在溶解度上的差异,通过______________________________________,然后趁热过滤分离NaCl晶体,并得到50%的NaOH溶液(填写设计方案,无需计算具体数据);
(4)写出电解饱和食盐水的反应方程式_____________;
如果在实验室中电解200ml饱和食盐水,一段时间后电源负极连接的电极处收集到224ml气体(已换算成标况),此时溶液中NaOH的物质的量浓度为__________mol·L-1(不考虑生成气体的溶解与反应,以及溶液体积的变化);
(5)分离出NaCl后的母液经过下列流程可以制取溴:
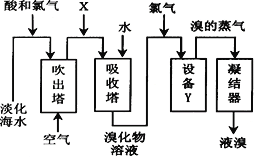
①若物质X是SO2,那么在这一环节中体现SO2_____________(填“氧化性”或“还原性”);
②若物质X是Na2CO3,则需要把氯气换成硫酸,此时吸收塔中发生的反应Br2+Na2CO3=NaBrO3+CO2+NaBr,配平该反应_____________。若有48 g溴完全反应,转移电子的物质的量为_____________ mol;
③在吹出塔中通入热空气或水蒸气吹出Br2,利用了溴的(填序号)_____________;
a.氧化性b.还原性c.挥发性d.腐蚀性
④设备Y在实验室中可以通过酒精灯、温度计、_____________等玻璃仪器组成的装置实现。
【答案】正 bc 加热蒸发,使NaCl结晶 2NaCl+2H2O ![]() H2↑+2NaOH+Cl2↑ 0.1 还原性 3 3 1 3 5 0.5 c 蒸馏烧瓶
H2↑+2NaOH+Cl2↑ 0.1 还原性 3 3 1 3 5 0.5 c 蒸馏烧瓶
【解析】
(1) 在电解过程中,![]()
![]() Cl2发生氧化反应;(2)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化,但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面;(3)根据氯化钠溶解度随温度变化较小的性质分析;(4)电解饱和食盐水生成氯气、氢气、氢氧化钠;电源负极连接的电极生成氢气,根据化学方程式计算生成0.01mol氢气时,溶液中NaOH的物质的量浓度。(5)①若物质X是SO2,则吸收塔中发生反应
Cl2发生氧化反应;(2)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化,但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面;(3)根据氯化钠溶解度随温度变化较小的性质分析;(4)电解饱和食盐水生成氯气、氢气、氢氧化钠;电源负极连接的电极生成氢气,根据化学方程式计算生成0.01mol氢气时,溶液中NaOH的物质的量浓度。(5)①若物质X是SO2,则吸收塔中发生反应![]() ;②根据化合价升降总数相等和原子守恒配平方程式;③溴加热易挥发;④根据流程图,设备Y为蒸馏装置。
;②根据化合价升降总数相等和原子守恒配平方程式;③溴加热易挥发;④根据流程图,设备Y为蒸馏装置。
(1) 在电解过程中,![]()
![]() Cl2发生氧化反应,Cl2在与电源极正极相连的电极(阳极)上生成;(2)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化,但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,所以选bc;(3)因为NaOH溶解度随温度变化较大、NaCl溶解度随温度变化较小,通过加热蒸发,使NaCl结晶,然后趁热过滤分离NaCl晶体,并得到50%的NaOH溶液。(4)电解饱和食盐水生成氯气、氢气、氢氧化钠,反应化学方程式是2NaCl+2H2O
Cl2发生氧化反应,Cl2在与电源极正极相连的电极(阳极)上生成;(2)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化,但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,所以选bc;(3)因为NaOH溶解度随温度变化较大、NaCl溶解度随温度变化较小,通过加热蒸发,使NaCl结晶,然后趁热过滤分离NaCl晶体,并得到50%的NaOH溶液。(4)电解饱和食盐水生成氯气、氢气、氢氧化钠,反应化学方程式是2NaCl+2H2O ![]() H2↑+2NaOH+Cl2↑ ;设溶液中NaOH的物质的量浓度为c mol/L;
H2↑+2NaOH+Cl2↑ ;设溶液中NaOH的物质的量浓度为c mol/L;
2NaCl+2H2O ![]() H2↑+2NaOH+Cl2↑
H2↑+2NaOH+Cl2↑
1mol 2mol
0.01mol c![]() 0.2L
0.2L
![]()
C=0.1cmol/L;
(5)①若物质X是SO2,则吸收塔中发生反应![]() ,SO2中硫元素化合价升高,体现SO2的还原性;②根据化合价升降总数相等和原子守恒配平方程式为3Br2+3Na2CO3=NaBrO3+3CO2+5NaBr;根据方程式,3mol Br2参加反应转移5mol电子,48 g溴的物质的量是0.3mol,完全反应转移电子的物质的量为0.5mol。③在吹出塔中通入热空气或水蒸气吹出Br2,利用了溴的挥发性,选c;④根据流程图,设备Y为蒸馏装置,所以在实验室中可以通过酒精灯、温度计、蒸馏烧瓶等玻璃仪器组成的装置实现。
,SO2中硫元素化合价升高,体现SO2的还原性;②根据化合价升降总数相等和原子守恒配平方程式为3Br2+3Na2CO3=NaBrO3+3CO2+5NaBr;根据方程式,3mol Br2参加反应转移5mol电子,48 g溴的物质的量是0.3mol,完全反应转移电子的物质的量为0.5mol。③在吹出塔中通入热空气或水蒸气吹出Br2,利用了溴的挥发性,选c;④根据流程图,设备Y为蒸馏装置,所以在实验室中可以通过酒精灯、温度计、蒸馏烧瓶等玻璃仪器组成的装置实现。


科目:高中化学 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),电解中发现Ag电极有气体产生。请回答下列问题。

甲池 乙池
(1)B是铅蓄电池的________极,放电过程中A电极反应式:_______________________。
(2)电解后甲池中电解液的pH________(填“减小”“增大”或“不变”)。若甲池中产生气体11.2L(标准状况下),此时乙池中理论上Zn电极最多产生固体________ g。
(3)乙池中 C(碳)电极是_________极。C电极的电极反应式是___________________,反应一段时间后,向乙池中加入一定量的___________(填化学式)固体,能使CuSO4溶液恢复到原浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4﹣O2燃料电池具有放电稳定,无污染等优点,如图用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图,其中氯化钠溶液滴有酚酞试液。已知甲烷氧气燃料电池的总反应式为:CH4+2O2+2KOH K2CO3+3H2O请认真读图,回答以下问题:
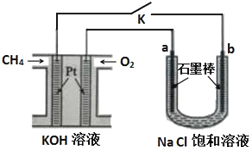
(1)请写出通入甲烷气体的一极所发生的电极反应式:____________________,其附近的pH值________(填“不变”或“变大”或“变小”) 通入O2气体的一极所发生的电极反应式:_______________,其附近的pH值________(填“不变”或“变大”或“变小”)。
(2)a为_______极,电极反应式为______________;b为_______极,电极反应式为_________________,现象是_______________;总方程式为 ____________________________。
(3)如果通入1mol的甲烷完全参与电极反应,则电路中转移___________mol的电子,a电极产生的气体在标准状况下的体积为______________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A. ![]() 、
、 ![]() 是质量数和电子数相等的两种微粒,中子数也相等
是质量数和电子数相等的两种微粒,中子数也相等
B. ![]() 原子的质子数与中子数差50
原子的质子数与中子数差50
C. 35Cl和37Cl两者互为同位素
D. 当氘原子转变为氕原子发生了分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.反应C(s)+CO2(g)=2CO(g);△H>0,在任何条件下均不能自发进行
B.铅蓄电池在放电过程中,溶液的PH值增加
C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:

已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/ L NaOH 溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/LCH3COOH溶液,得到2 条滴定曲线,如下图所示:
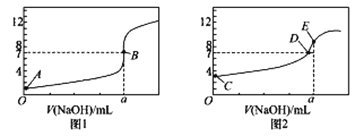
(1)由A、C点判断,滴定HCl溶液的曲线是_____(填“图1”或“图2”);
(2)a=____ mL;
(3)c(Na+ )=c(CH3COO-)的点是_________;
(4)E点对应离子浓度由大到小的顺序为___________________________。
(5)当NaOH 溶液滴定CH3COOH 溶液过程中,NaOH溶液消耗了10.00 mL时,则此时混合液中c(CH3COOH)____c (CH3COO-)(“>”或“<”或“=” )。
(6)在25℃ 时,将c mol/L的醋酸溶液与0.2mol/LNaOH溶液等体积混合后溶液恰好星中性,用含c 的代数式表示CH3COOH 的电离常数Ka=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为___________,原子个数比为____________,分子的物质的量之比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为___________,原子个数比为___________,质量比为__________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________(用含NA的式子表示)。
(4)实验室中配制2mol·L—1的NaOH溶液950mL,配制时需称取的NaOH的质量是_____________。
(5)在标准状况下15gCO与CO2的混合气体,体积为11.2L混合气体的平均摩尔质量是__________;CO2与CO的体积之比是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com