
����Ŀ�������£���0.1000 mol/ L NaOH ��Һ�ֱ�ζ�20.00 mL 0.1000 mol/L HCl��Һ��20.00 mL 0.1000 mol/LCH3COOH��Һ���õ�2 ���ζ����ߣ�����ͼ��ʾ:
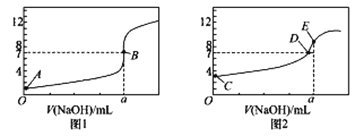
��1����A��C���жϣ��ζ�HCl��Һ��������_____(����ͼ1������ͼ2��)��
��2��a=____ mL��
��3��c(Na+ )=c(CH3COO-)�ĵ���_________��
��4��E���Ӧ����Ũ���ɴ�С��˳��Ϊ___________________________��
��5����NaOH ��Һ�ζ�CH3COOH ��Һ�����У�NaOH��Һ������10.00 mLʱ�����ʱ���Һ��c(CH3COOH)____c (CH3COO-)(��>������<������=�� )��
��6����25�� ʱ����c mol/L�Ĵ�����Һ��0.2mol/LNaOH��Һ�������Ϻ���Һǡ�������ԣ��ú�c �Ĵ���ʽ��ʾCH3COOH �ĵ��볣��Ka=___________��
���𰸡� ͼ1 20.00 D c(Na��)>c(CH3COO��)>c(OH��)>c(H��) �� ![]()
����������1�����⿼��һԪǿ����һԪ����ıȽϣ�HCl����ǿ�ᣬ0.1mol��L��1��HCl��Һ��pH=1��CH3COOH�����ᣬ0.1mol��L��1��CH3COOH��Һ��pH>1������ͼ�����㣬ͼ1Ϊ�ζ�HCl�����ߣ�ͼ2Ϊ�ζ�CH3COOH�����ߣ���2�����⿼���кͷ�Ӧ��������ǡ����ȫ��Ӧʱ����Һ��pH=7��������NaOH�����Ϊ20.00mL����3����������Ũ�ȴ�С�ȱȽϣ����ݵ���غ㣬c(Na��)��c(H��)=c(CH3COO��)��c(OH��)����Ϊc(Na��)=c(CH3COO��)����c(H��)=c(OH��)��D�����Ҫ��4�����⿼������Ũ�ȴ�С�Ƚϣ����ݣ�2����E���������������ǡ����ȫ��Ӧ������ΪCH3COONa������Ũ�ȴ�С˳����c(Na��)>c(CH3COO��)>c(OH��)>c(H��)����5�����⿼������Ũ�ȴ�С�Ƚϣ�NaOH��Һ����10.00mL����ʱ��Һ������ΪCH3COOH��CH3COONa���������ʵ�����ȣ�����ͼ�������������Ƶ����Ϊ10.00mLʱ����Һ�����ԣ�˵��CH3COOH�ĵ���̶ȴ���CH3COO����ˮ��̶ȣ���c(CH3COOH)<c(CH3COO��)����6�����⿼�����ƽ�ⳣ���ļ��㣬���ݵ���غ㣬c(Na��)��c(H��)=c(CH3COO��)��c(OH��)������Ϊc(Na��)=c(CH3COO��)��c(CH3COO��)=0.2/2mol/l=0.1mol/l��c(CH3COOH)=(c/2��0.1)mol��L��1����Һǡ��Ϊ���ԣ�c(H��)=10��7mol��L��1������ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬��K= 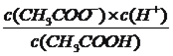 =
= 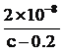 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����������������Һ����м��ϡ������Լ��Ʊ�������������������װ����ͼ��ʾ��
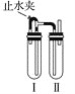
(1)���Թܢ��������Լ���____________________��
(2)���Թܢ��������Լ���____________________��
(3)Ϊ���Ƶð�ɫ�������������������Թܢ�͢��м����Լ�����ֹˮ�У��������Ӻ��ʵ�鲽����______________________________________��
(4)�������ɵ����������������ܽϳ�ʱ�䱣�ְ�ɫ����������_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮɹ�ƺ���˿ɵõ�����ʳ�κ�ĸҺ���ȼ�Ե�ⱥ��ʳ��ˮ��ȡNaOH�Ĺ�������ʾ��ͼ���£�
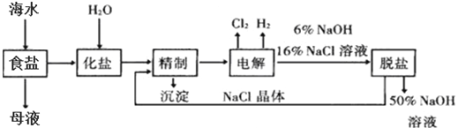
��1���ڵ������У�Cl2�����Դ_______��������������������ĵ缫�����ɣ�
��2�����ƹ���Ϊ��ȥ��Һ�е�����Ca2+��Mg2+��SO42-�������Լ�˳���������_____________��
a���ȼ�NaOH���ټ�Na2CO3���ټ�BaCl2
b���ȼ�NaOH�����Ba(OH)2���ټ�Na2CO3
c���ȼ�BaCl2�����NaOH���ټ�Na2CO3
��3�����ι���������NaOH���ܽ�����¶ȱ仯�ϴ�NaCl���ܽ�����¶ȱ仯��С�����ܽ���ϵIJ��죬ͨ��______________________________________��Ȼ����ȹ��˷���NaCl���壬���õ�50%��NaOH��Һ����д��Ʒ������������������ݣ���
��4��д����ⱥ��ʳ��ˮ�ķ�Ӧ����ʽ_____________��
�����ʵ�����е��200ml����ʳ��ˮ��һ��ʱ����Դ�������ӵĵ缫���ռ���224ml���壨�ѻ���ɱ��������ʱ��Һ��NaOH�����ʵ���Ũ��Ϊ__________mol��L-1������������������ܽ��뷴Ӧ���Լ���Һ����ı仯����
��5�������NaCl���ĸҺ�����������̿�����ȡ��:
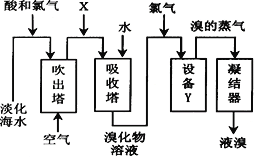
��������X��SO2����ô����һ����������SO2_____________��������ԡ���ԭ�ԡ�����
��������X��Na2CO3������Ҫ�������������ᣬ��ʱ�������з����ķ�ӦBr2+Na2CO3=NaBrO3+CO2+NaBr����ƽ�÷�Ӧ_____________������48 g����ȫ��Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_____________ mol��
���ڴ�������ͨ���ȿ�����ˮ��������Br2����������ģ�����ţ�_____________��
a��������b����ԭ��c���ӷ���d����ʴ��
���豸Y��ʵ�����п���ͨ���ƾ��ơ��¶ȼơ�_____________�Ȳ���������ɵ�װ��ʵ�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ�����������ͽ��ͻ���۶���ȷ����
ѡ�� | ʵ����� | ���� | ���ͻ���� |
A | ��Na2CO3��Һ��0.1mol/L ϡ�͵�0.01mol/L�����ܶ�pH | ��ҺpH��С | ϡ�ͺ�CO32-��ˮ��̶ȼ�С |
B | ��һ��Ũ�ȵ�CuSO4��Һ�� ͨ��������H2S���� | ���ֺ�ɫ���� | H2S�����Ա�H2SO4ǿ |
C | ��ʢ���غ�ɫNO2�����ע�� ����10 mL ѹ����5 mL | ������ɫ��ѹ ��ǰ��dz | ��Ӧ2NO2 |
D | �������ɵ�AgCl �����е��� ϡKI��Һ���� | ��ɫ����ת��Ϊ ��ɫ���� | Ksp (AgCl )>Ksp (AgI) |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����ػ����������������о�����Ҫ�����á��ش�����������
��1��ͭԪ�������ڱ��е�λ����______________����̬ͭԭ�������������ռ������ܲ�ķ�����_________________��ռ�ݸ�����ܲ�ĵ�����Ϊ__________________��
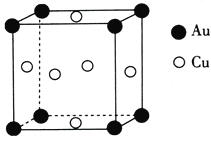
��2����һ�������£�����������γɵĻ������Ϊ��������������Cu9Al4��Cu5Zn8�ȡ�ij��������������Է�����ԭ������ά�ռ���������������������ý�������������__________(����塱�Ǿ��塱)��
��3��ͭ������±��[(SCN)2]��Ӧ����Cu(SCN)2��1mol(SCN)2�����к�����������ĿΪ______________�� (SCN)2��Ӧ������������(H-S-C![]() N)����������(H-N=C=S)���֡�������ǰ�߷е���ں�������ԭ����____________________________��
N)����������(H-N=C=S)���֡�������ǰ�߷е���ں�������ԭ����____________________________��
��4��ͭ������ͭԭ�ӵĶѻ���ʽΪ���������ѻ���ÿ��ͭԭ����Χ���������ͭԭ�Ӹ���Ϊ________��
��5��ͭ����γɵĽ���������ľ����ṹ��ͼ��ʾ���侧���߳�Ϊa nm���ý�����������ܶ�Ϊ____________(�ú�a��NA�Ĵ���ʽ��ʾ)g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ϸ����Ҫ��ѧ�ɷֵ�����������ȷ����(�� ��)
A. �����ʵĶ������백��������ࡢ��Ŀ������˳��Ͱ�����Ŀռ�ṹ�������
B. ���������R����-CH2-CH2-S-CH3�������ķ���ʽ��C5H11O2NS
C. �������Ǻ�����Ⱦɫ�����Ҫ�ɷ�֮��
D. ���̴����Լ��ء�ά����D������֬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���׳ص��ܷ�ӦʽΪ��N2H4+O2=N2+H2O�����й��ڸõ�ع���ʱ��˵����ȷ������ ��
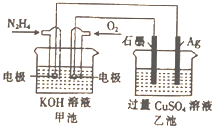
A. ��װ�ù���ʱ��Ag�缫������������
B. �׳��и�����ӦΪN2H4-4e-=N2+4H+
C. �׳غ��ҳ��е���Һ��pH����С
D. ���׳�������0.1molN2H4ʱ���ҳ���������������6.4g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA(g)��B(g) ![]() C(g)��D(g)��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.20 mol A��0.20 mol B,10 sʱ��ƽ�⡣����˵������ȷ����
C(g)��D(g)��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����ʾ��830 ��ʱ����һ��2 L���ܱ������г���0.20 mol A��0.20 mol B,10 sʱ��ƽ�⡣����˵������ȷ����
�¶�/�� | 700 | 830 | 1200 |
Kֵ | 1.7 | 1.0 | 0.4 |
A. �ﵽƽ���B��ת����Ϊ50%
B. ����ѹǿ�������淴Ӧ���ʾ��ӿ�
C. �÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�
D. ��Ӧ��ʼ��ƽ�⣬A��ƽ����Ӧ����v(A)��0.005 mol��L��1��s��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com