
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
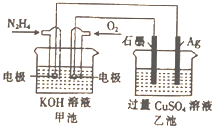
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
【答案】C
【解析】甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极电极反应为 Cu2++2e-=Cu、阳极反应为4OH--4e-=2H2O+O2↑,A.通入肼的电极为负极,负极与阴极相连,银极为阴极,铜离子得电子生成铜单质,选项A错误;B.甲池负极反应为N2H4-4e-+4OH-=N2+4H2O,氢离子不能在碱性溶液中出现,选项B错误;C.甲池生成水,导致溶液中KOH浓度降低,则溶液pH减小,乙池中氢氧根离子放电,导致溶液pH减小,选项C正确;D.甲池N2H4-4e-+4OH-=N2+4H2O,消耗0.1mol N2H4时,转移0.4mol电子,乙池Cu2++2e-=Cu,产生0.2mol铜,为12.8g固体,选项D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A. ![]() 、
、 ![]() 是质量数和电子数相等的两种微粒,中子数也相等
是质量数和电子数相等的两种微粒,中子数也相等
B. ![]() 原子的质子数与中子数差50
原子的质子数与中子数差50
C. 35Cl和37Cl两者互为同位素
D. 当氘原子转变为氕原子发生了分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/ L NaOH 溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/LCH3COOH溶液,得到2 条滴定曲线,如下图所示:
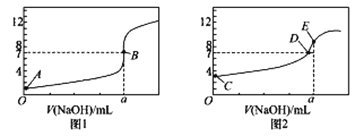
(1)由A、C点判断,滴定HCl溶液的曲线是_____(填“图1”或“图2”);
(2)a=____ mL;
(3)c(Na+ )=c(CH3COO-)的点是_________;
(4)E点对应离子浓度由大到小的顺序为___________________________。
(5)当NaOH 溶液滴定CH3COOH 溶液过程中,NaOH溶液消耗了10.00 mL时,则此时混合液中c(CH3COOH)____c (CH3COO-)(“>”或“<”或“=” )。
(6)在25℃ 时,将c mol/L的醋酸溶液与0.2mol/LNaOH溶液等体积混合后溶液恰好星中性,用含c 的代数式表示CH3COOH 的电离常数Ka=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,2.24LCO和 CO2混合气体中含有的碳原子数目为0.1NA
B. 在非标准状况下,1mol任何气体的体积不可能是22.4L
C. 标准状况下,22.4L酒精(CH3CH2OH)的分子数为NA
D. 同温同压下,相同质量的二氧化碳和二氧化硫的体积比是16:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2氧化密度为1.19g·cm-3、溶质质量分数为36.5%的HCl溶液。反应方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式______________________________。
(2)该反应的氧化剂为_____________,氧化产物是___________。
(3)17.4gMnO2能与_____摩尔HCl发生上述反应?有______摩尔HCl被氧化?
(4)若在标准状况下产生4.48L Cl2,则反应中转移电子_______摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4容易与H+反应产生氢气而成为储氢材料研究的热点。以硼酸为原料制备NaBH4的一种工艺流程如下图所示:
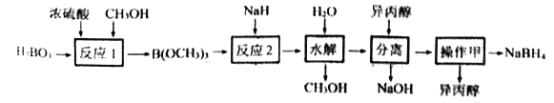
已知: ①H3BO3电离:H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
②反应1: H3BO3+3CH3OH![]() B(OCH3)3+3H2O
B(OCH3)3+3H2O
③反应2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3是____元酸,NaH的电子式为_______________。
(2)NaBH4与水剧烈反应放出H2。反应的化学方程式为________________。
(3)反应1属于______(填有机反应类型),反应过程中蒸出B(OCH3)3的目的是__________。
(4)“水解”时产生的大量NaOH,减缓了NaBH4与水的反应。在该步骤中,与水反应生成大量NaOH的物质是_________。
(5)“分离”后得到NaBH4的异丙醇溶液。操作甲是_____________。
(6)上述流程中可以循环使用的物质是____________。
(7)以惰性电极电解Na[B(OH)4]与NaOH 混合溶液也能制得NaBH4。阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为___________,原子个数比为____________,分子的物质的量之比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为___________,原子个数比为___________,质量比为__________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________(用含NA的式子表示)。
(4)实验室中配制2mol·L—1的NaOH溶液950mL,配制时需称取的NaOH的质量是_____________。
(5)在标准状况下15gCO与CO2的混合气体,体积为11.2L混合气体的平均摩尔质量是__________;CO2与CO的体积之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)十O2(g)![]() 2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. 在恒温、恒容条件下,达到平衡后继续加入少量SO3平衡将向正反应方向移动,所以SO3的体积百分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸乙酯存在天然苏合香中,具有类似水果的香气,气息清面甜润,是一种增香剂,合成肉桂酸乙酯的路线如图所示.
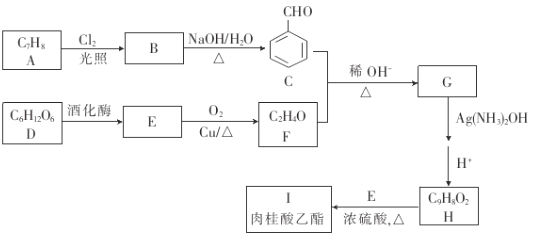
已知:
①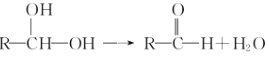
②![]()
回答下列问题:
(1)A的名称是_____,C中含有的官能团的名称是_____.
(2)B的结构简式是__,E→F的反应类型是_____.
(3)G分子中最多有_____个原子共平面.
(4)H+E→I的化学方程式为____.
(5)与H互为同分异构体,且同时满足下列条件的有机物的结构(不考虑立体异构)有________种.
①能发生银镜反应②能与氧化铁溶液发生显色反应③除苯环外不含其他环其中核磁共振氢谱5组峰,且峰面积之比为1:2:2:2:1的结构简式为____.
(6)参照肉桂酸乙酯的合成路线,设计一条以E为起始原料制备1﹣丁烯的合成路线:___.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com