
【题目】下列关于细胞主要化学成分的叙述,不正确的是( )
A. 蛋白质的多样性与氨基酸的种类、数目、排列顺序和氨基酸的空间结构密切相关
B. 若甲硫氨酸的R基是-CH2-CH2-S-CH3,则它的分子式是C5H11O2NS
C. 脱氧核糖核酸是染色体的主要成分之-
D. 胆固醇、性激素、维生素D都属于脂质
科目:高中化学 来源: 题型:
【题目】CH4﹣O2燃料电池具有放电稳定,无污染等优点,如图用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图,其中氯化钠溶液滴有酚酞试液。已知甲烷氧气燃料电池的总反应式为:CH4+2O2+2KOH K2CO3+3H2O请认真读图,回答以下问题:
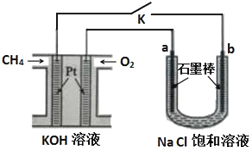
(1)请写出通入甲烷气体的一极所发生的电极反应式:____________________,其附近的pH值________(填“不变”或“变大”或“变小”) 通入O2气体的一极所发生的电极反应式:_______________,其附近的pH值________(填“不变”或“变大”或“变小”)。
(2)a为_______极,电极反应式为______________;b为_______极,电极反应式为_________________,现象是_______________;总方程式为 ____________________________。
(3)如果通入1mol的甲烷完全参与电极反应,则电路中转移___________mol的电子,a电极产生的气体在标准状况下的体积为______________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:

已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/ L NaOH 溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/LCH3COOH溶液,得到2 条滴定曲线,如下图所示:
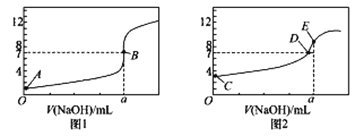
(1)由A、C点判断,滴定HCl溶液的曲线是_____(填“图1”或“图2”);
(2)a=____ mL;
(3)c(Na+ )=c(CH3COO-)的点是_________;
(4)E点对应离子浓度由大到小的顺序为___________________________。
(5)当NaOH 溶液滴定CH3COOH 溶液过程中,NaOH溶液消耗了10.00 mL时,则此时混合液中c(CH3COOH)____c (CH3COO-)(“>”或“<”或“=” )。
(6)在25℃ 时,将c mol/L的醋酸溶液与0.2mol/LNaOH溶液等体积混合后溶液恰好星中性,用含c 的代数式表示CH3COOH 的电离常数Ka=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生物体细胞内部分有机化合物的概念图,请回答下列问题。
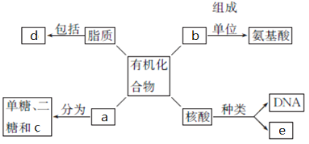
(1)小麦种子中的储能物质c是__________,人和动物细胞中的储能物质c是____________。
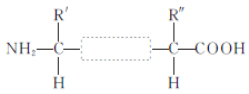
(2)两个氨基酸发生脱水缩合反应时,产物是__________和__________,下图方框内的结构简式是____________。
(3)b结构的多样性决定其功能的多样性,如作为结构物质、免疫功能、___________、___________、信息传递等。
(4)SARS病毒的遗传信息贮存在e中,e物质初步水解的产物是________________;在小麦叶肉细胞中,e主要存在于____________中。
(5)d中构成生物膜的主要是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 标准状况下,2.24LCO和 CO2混合气体中含有的碳原子数目为0.1NA
B. 在非标准状况下,1mol任何气体的体积不可能是22.4L
C. 标准状况下,22.4L酒精(CH3CH2OH)的分子数为NA
D. 同温同压下,相同质量的二氧化碳和二氧化硫的体积比是16:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2氧化密度为1.19g·cm-3、溶质质量分数为36.5%的HCl溶液。反应方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式______________________________。
(2)该反应的氧化剂为_____________,氧化产物是___________。
(3)17.4gMnO2能与_____摩尔HCl发生上述反应?有______摩尔HCl被氧化?
(4)若在标准状况下产生4.48L Cl2,则反应中转移电子_______摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为___________,原子个数比为____________,分子的物质的量之比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为___________,原子个数比为___________,质量比为__________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________(用含NA的式子表示)。
(4)实验室中配制2mol·L—1的NaOH溶液950mL,配制时需称取的NaOH的质量是_____________。
(5)在标准状况下15gCO与CO2的混合气体,体积为11.2L混合气体的平均摩尔质量是__________;CO2与CO的体积之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在生产生活中有着广泛的应用,某校研究性学习小组的同学学习完氮的有关性质之后,准备对氨的性质进行实验探究。
(1)实验室制取氨气的化学方程式为_________________________________。
(2)某同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?________(填“能”或“否”),理由是_________________________。
(3)该小组的同学设计了如下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。
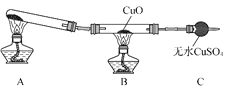
①利用装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。已知红色物质为一种单质,则氨气与CuO反应的化学方程式为________________。
②有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+―→Cu+Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O:______________。
(4)该小组的同学根据"侯氏制碱法"原理,进行碳酸氢钠的制备,有关反应为:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
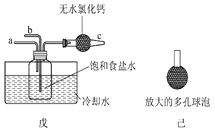
某同学用上图中戊装置(其他装置未画出)进行实验。
①实验时,须先从a管通入________气体(填化学式),然后从b管持续通入另一种气体。
②有同学建议在戊装置的b管下端连接己装置,理由是____________________。
③碳酸氢钠受热所得固体12.28 g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00 g,则所得固体中碳酸钠的质量分数为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com