
【题目】CH4﹣O2燃料电池具有放电稳定,无污染等优点,如图用甲烷氧气燃料电池电解饱和氯化钠溶液的模型图,其中氯化钠溶液滴有酚酞试液。已知甲烷氧气燃料电池的总反应式为:CH4+2O2+2KOH K2CO3+3H2O请认真读图,回答以下问题:
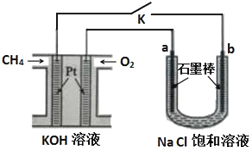
(1)请写出通入甲烷气体的一极所发生的电极反应式:____________________,其附近的pH值________(填“不变”或“变大”或“变小”) 通入O2气体的一极所发生的电极反应式:_______________,其附近的pH值________(填“不变”或“变大”或“变小”)。
(2)a为_______极,电极反应式为______________;b为_______极,电极反应式为_________________,现象是_______________;总方程式为 ____________________________。
(3)如果通入1mol的甲烷完全参与电极反应,则电路中转移___________mol的电子,a电极产生的气体在标准状况下的体积为______________L。
【答案】 CH4﹣8e﹣+10OH﹣═CO32﹣+7H2O 变小 O2+2H2O+4e- =4OH- 变大 阳极 2Cl--2e- = Cl2↑ 阴极 2H++ 2e- = H2 ↑ b电极附近变红 2NaCl+2H2O![]() 2NaOH+ H2↑ + Cl2↑ 8mol 89.6L
2NaOH+ H2↑ + Cl2↑ 8mol 89.6L
【解析】本题考查原电池电极反应式的书写、电解原理的应用以及计算,(1)左边装置为燃料电池,通入甲烷的一极为负极,因为电解质为KOH溶液,因此负极反应式为CH4+10OH--8e-=CO32-+7H2O,根据负极反应式,消耗OH-,因此负极附近的pH变小;通入氧气一极为正极,反应式为O2+2H2O+4e-=4OH-,产生了OH-,则pH变大;(2)a与燃料电池的正极相连,即a电极为阳极,电极反应式为2Cl--2e-=Cl2↑,b电极连接燃料电池的负极,则b电极为阴极,电极反应式为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,因此NaCl溶液中滴入酚酞,则b电极现象是b电极附近变红,总反应式为 2NaCl+2H2O ![]() 2NaOH+ H2↑ + Cl2↑;(3) 根据(1)1mol甲烷完全参与反应,转移电子物质的量为8mol,根据电子守恒,建立关系式为CH4~8e-~4Cl2,消耗1mol甲烷,a电极产生4molCl2,即氯气的体积为4×22.4L=89.6L。
2NaOH+ H2↑ + Cl2↑;(3) 根据(1)1mol甲烷完全参与反应,转移电子物质的量为8mol,根据电子守恒,建立关系式为CH4~8e-~4Cl2,消耗1mol甲烷,a电极产生4molCl2,即氯气的体积为4×22.4L=89.6L。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
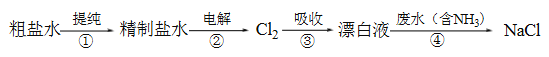
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是
A. Al3+、Na+、HCO3-、[Al(OH)4]-
B. Ca2+、HCO3-、Cl-、K+
C. Fe3+、H+、SO42-、S2-
D. Fe2+、NO3-、Na+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氢氧化钠溶液、铁屑、稀硫酸等试剂制备氢氧化亚铁沉淀,其装置如图所示。
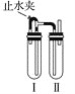
(1)在试管Ⅰ里加入的试剂是____________________。
(2)在试管Ⅱ里加入的试剂是____________________。
(3)为了制得白色氢氧化亚铁沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______________________________________。
(4)这样生成的氢氧化亚铁沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值.下列说法错误的是
A. 8.4g NaHCO3固体中含有的离子总数为0.3NA
B. 标准状况下,13.8gNO2与水充分反应转移的电子数目为0.2NA
C. 1L 1molL﹣1的NaClO溶液中ClO-的数目小于NA
D. 常温常压下,23g Na与O2充分反应,生成Na2O和Na2O2混合物时,转移电子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去混入CO2中的SO2和O2 , 下列试剂的使用顺序正确的是( )
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③浓H2SO4溶液 ④灼热的铜网 ⑤碱石灰
A.①③④
B.③④⑤
C.②④③
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(NO3)2常用于军事上生产绿色信号弹、曳光弹等。某生产BaCO3的化工厂生产排出大量的钡泥(主要含有BaCO3、BaSO3、Ba(FeO2)2等,该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),部分工艺流程如下:
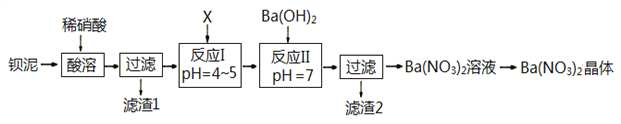
已知:pH=3.2时,可使Fe3+沉淀完全;
请回答下列问题:
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌、过滤、洗涤。试用离子方程式说明提纯原理:______________________________。
(2)酸溶时,Ba(FeO2)2与HNO3反应的化学方程式为_______________________________。
(3)该厂结合本厂实际,化合物X最好选用_________
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3
(4)滤渣1和滤渣2洗涤产生的废液不能直接排入环境,原因是_______________________。
(5)①反应I需调节溶液pH值范围在4~5,目的是________________________________。
②验证该步骤中沉淀已完全的实验操作是_____________________________________。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为_____________。(提示:M(Ba(NO3)2)= 261 g/mol,M(BaSO4)= 233 g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将海水晒制后过滤可得到粗制食盐和母液,氯碱厂以电解饱和食盐水制取NaOH的工艺流程示意图如下:
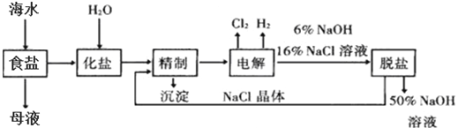
(1)在电解过程中,Cl2在与电源_______(填“正”或“负”)极相连的电极上生成;
(2)精制过程为除去溶液中的少量Ca2+、Mg2+、SO42-,加入试剂顺序合理的是_____________;
a.先加NaOH,再加Na2CO3,再加BaCl2
b.先加NaOH,后加Ba(OH)2,再加Na2CO3
c.先加BaCl2,后加NaOH,再加Na2CO3
(3)脱盐工序中利用NaOH(溶解度随温度变化较大)和NaCl(溶解度随温度变化较小)在溶解度上的差异,通过______________________________________,然后趁热过滤分离NaCl晶体,并得到50%的NaOH溶液(填写设计方案,无需计算具体数据);
(4)写出电解饱和食盐水的反应方程式_____________;
如果在实验室中电解200ml饱和食盐水,一段时间后电源负极连接的电极处收集到224ml气体(已换算成标况),此时溶液中NaOH的物质的量浓度为__________mol·L-1(不考虑生成气体的溶解与反应,以及溶液体积的变化);
(5)分离出NaCl后的母液经过下列流程可以制取溴:
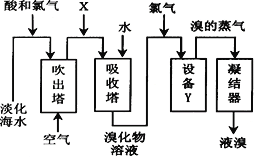
①若物质X是SO2,那么在这一环节中体现SO2_____________(填“氧化性”或“还原性”);
②若物质X是Na2CO3,则需要把氯气换成硫酸,此时吸收塔中发生的反应Br2+Na2CO3=NaBrO3+CO2+NaBr,配平该反应_____________。若有48 g溴完全反应,转移电子的物质的量为_____________ mol;
③在吹出塔中通入热空气或水蒸气吹出Br2,利用了溴的(填序号)_____________;
a.氧化性b.还原性c.挥发性d.腐蚀性
④设备Y在实验室中可以通过酒精灯、温度计、_____________等玻璃仪器组成的装置实现。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞主要化学成分的叙述,不正确的是( )
A. 蛋白质的多样性与氨基酸的种类、数目、排列顺序和氨基酸的空间结构密切相关
B. 若甲硫氨酸的R基是-CH2-CH2-S-CH3,则它的分子式是C5H11O2NS
C. 脱氧核糖核酸是染色体的主要成分之-
D. 胆固醇、性激素、维生素D都属于脂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com