
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1
【答案】C
【解析】试题分析:设平衡时参加反应的B的物质的量为xmol,则:
A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
开始(mol·L-1):0.2 0.2 0 0
变化(mol·L-1):x x x x
平衡(mol·L-1):0.2-x 0.2-x x x
故![]() =1,解得x=0.1
=1,解得x=0.1
所以平衡时B的转化率为![]() ×100%=50%,故A正确;增大压强,反应混合物的浓度都增大,故正、逆反应速率都增大,故B正确;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故C错误;反应初始至平衡,A的平均反应速率v(A)=
×100%=50%,故A正确;增大压强,反应混合物的浓度都增大,故正、逆反应速率都增大,故B正确;由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,故正反应为放热反应,故C错误;反应初始至平衡,A的平均反应速率v(A)=![]() =0.005mol·L-1·s-1,故D正确,故选C。
=0.005mol·L-1·s-1,故D正确,故选C。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/ L NaOH 溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/LCH3COOH溶液,得到2 条滴定曲线,如下图所示:
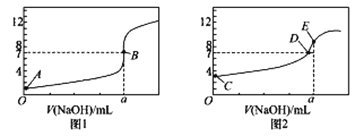
(1)由A、C点判断,滴定HCl溶液的曲线是_____(填“图1”或“图2”);
(2)a=____ mL;
(3)c(Na+ )=c(CH3COO-)的点是_________;
(4)E点对应离子浓度由大到小的顺序为___________________________。
(5)当NaOH 溶液滴定CH3COOH 溶液过程中,NaOH溶液消耗了10.00 mL时,则此时混合液中c(CH3COOH)____c (CH3COO-)(“>”或“<”或“=” )。
(6)在25℃ 时,将c mol/L的醋酸溶液与0.2mol/LNaOH溶液等体积混合后溶液恰好星中性,用含c 的代数式表示CH3COOH 的电离常数Ka=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为___________,原子个数比为____________,分子的物质的量之比为__________。
(2)等温等压下,等体积的O2和O3所含分子个数比为___________,原子个数比为___________,质量比为__________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________(用含NA的式子表示)。
(4)实验室中配制2mol·L—1的NaOH溶液950mL,配制时需称取的NaOH的质量是_____________。
(5)在标准状况下15gCO与CO2的混合气体,体积为11.2L混合气体的平均摩尔质量是__________;CO2与CO的体积之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)十O2(g)![]() 2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. 在恒温、恒容条件下,达到平衡后继续加入少量SO3平衡将向正反应方向移动,所以SO3的体积百分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家韦尔斯泰特,经过10年的艰苦努力,韦尔斯泰特用成吨的绿叶,终于提取到了绿叶中的神秘物质——叶绿素,正是因为叶绿素在植物体内所起到的奇特作用,才使我们人类得以生存。可以说,没有光合作用就没有人类的生存和发展。由于成功地提取了叶绿素,1915年,韦尔斯泰特荣获了诺贝尔化学奖。叶绿素的结构如图
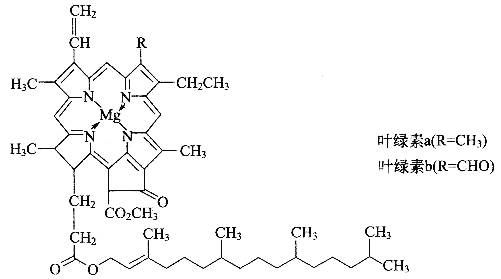
(1)光合作用产生氧气,氧气的一种同素异形体O3,在高空能吸收大量紫外线,保护地球上的人类和动植物免遭短波紫外线的伤害。请写出一种短周期元素形成的O3等电子体分子________,该分子的空间构型为________,中心原子的杂化类型是_________。
(2)镁是叶绿素中的重要组成元素,镁的基态原子价电子排布式为__________,叶绿素中镁形成的化学键类型有___________________。叶绿素不易溶于水,而溶于有机溶剂,如乙醇、丙酮、乙醚、氯仿等,是因为______________________________。
(3)叶绿素构成元素中,又属于二周期元素中,第一电离能由大到小的顺序(请用元素符号表示):_______________,理由是______________________________。
(4)叶绿素的构成元素中,H和Mg属于第一、三周期的元素,能形成一种离子型储氢材料,晶体结构如图所示:
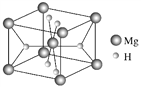
则 该晶体的化学式为__________________,已知该晶体的密度为ρ g·cm-3,晶胞的体积为________ cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在生产生活中有着广泛的应用,某校研究性学习小组的同学学习完氮的有关性质之后,准备对氨的性质进行实验探究。
(1)实验室制取氨气的化学方程式为_________________________________。
(2)某同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?________(填“能”或“否”),理由是_________________________。
(3)该小组的同学设计了如下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性。
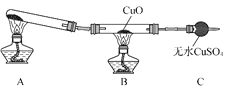
①利用装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。已知红色物质为一种单质,则氨气与CuO反应的化学方程式为________________。
②有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+―→Cu+Cu2+。请设计一个简单的实验检验该红色物质中是否含有Cu2O:______________。
(4)该小组的同学根据"侯氏制碱法"原理,进行碳酸氢钠的制备,有关反应为:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
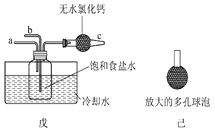
某同学用上图中戊装置(其他装置未画出)进行实验。
①实验时,须先从a管通入________气体(填化学式),然后从b管持续通入另一种气体。
②有同学建议在戊装置的b管下端连接己装置,理由是____________________。
③碳酸氢钠受热所得固体12.28 g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00 g,则所得固体中碳酸钠的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
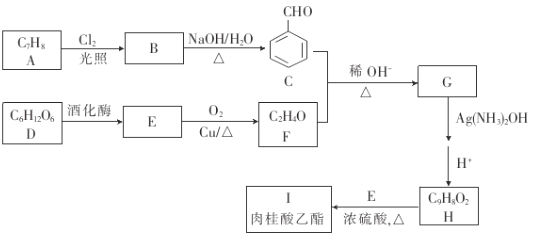
【题目】肉桂酸乙酯存在天然苏合香中,具有类似水果的香气,气息清面甜润,是一种增香剂,合成肉桂酸乙酯的路线如图所示.
已知:
①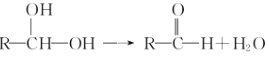
②![]()
回答下列问题:
(1)A的名称是_____,C中含有的官能团的名称是_____.
(2)B的结构简式是__,E→F的反应类型是_____.
(3)G分子中最多有_____个原子共平面.
(4)H+E→I的化学方程式为____.
(5)与H互为同分异构体,且同时满足下列条件的有机物的结构(不考虑立体异构)有________种.
①能发生银镜反应②能与氧化铁溶液发生显色反应③除苯环外不含其他环其中核磁共振氢谱5组峰,且峰面积之比为1:2:2:2:1的结构简式为____.
(6)参照肉桂酸乙酯的合成路线,设计一条以E为起始原料制备1﹣丁烯的合成路线:___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将 0.1mol/L 的 K2SO4 溶液 V 1 L 与 0 . 2 mo l / L 的 Al2(SO4)3溶液 V 2 L 混合,再加入 V 3 L 蒸馏水,假定溶液 总体积 V 总 =V1 +V 2 +V 3 .并测得混合液中三种离子物质的量浓度 分别为:K+:0 .1 mo l /L ,Al3+:0 .1 mo l /L,SO42-:0 . 2 mo l / L , 则 下 列 判 断 正 确 的 是( )
A. 一定是 2L K2SO4 溶液和 1L Al2(SO4)3溶液混合,再加 1L 蒸馏水
B. 混合液中K+浓度与Al3+浓度数值之和大于SO42-浓度数值
C. 三种液体体积比为 V1:V2:V3=2:1:1
D. 混合液中 K2SO4 物质的量等于 Al2(SO4)3物质的量的一半
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com