
【题目】长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
A. 第9列中元素中没有非金属元素
B. 只有第二列的元素原子最外层电子排布为ns2
C. 第四周期第10列元素是铁元素
D. 第15列元素原子的最外层电子排布为ns2np5
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】新能源汽车如(比亚迪秦、唐)相对传统汽车。有一系列的优点。如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒)。而新能源汽车一个核心部件为锂离子电池,下图是我国科学家报道的某种水溶液锂离子电池体系。下列叙述错误的是
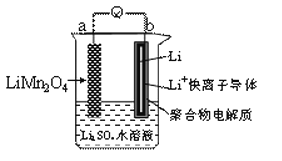
A. a为电池的正极
B. 电池充电反应为LiMn2O4=Li1-xMn2O4+xLi
C. 放电时,a极锂的化合价发生变化
D. 放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3、K2SO4和明矾的混合液中,如果SO42-的物质的量浓度为0.2 mol·L-1,当加入等体积的0.2 mol·L-1的KOH溶液时,生成的沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
A. 0.2 mol·L-1 B. 0.25 mol·L-1
C. 0.225mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨气的说法正确的是
A. 氨既能用浓硫酸干燥也能用无水CaCl2干燥
B. NH3是电解质,所以氨水能导电
C. NH3可以使干燥的红色石蕊试纸变蓝
D. 用水吸收NH3用如图装置可防止倒吸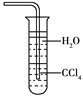
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( )
A. 0.05 mol B. 1 mol C. 1.05 mol D. 0.13 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】氟及其氟产品在工农业生产中应用非常广泛,回答下列问题;
(l)基态氟原子核外电子的运动状态有______种,这些电子的电子云形状有_________种,氟原子的价电子排布式为______________。
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2晶体中所含作用力的类型有_______;与HF2-互为等电子体的分子有______(举一例)。
(3)三氟化硼乙醚(![]() )熔点-58℃,沸点126~129℃,它属于_____________晶体。
)熔点-58℃,沸点126~129℃,它属于_____________晶体。
(4)氟化钙晶胞结构如下图所示,晶胞参数a=0.555 nm。
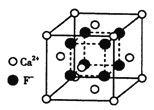
①Ca2+、F-的配位数分别为___________和___________。
②列式表示氟化钙晶体的密度________g/cm3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 原子最外层电子数为2的元素一定处于周期表ⅡA族
B. 主族元素的最高化合价与最低化合价的绝对值之和为8
C. K与水反应比Li与水反应剧烈
D. Li+和H-的离子半径相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比_________.
(2)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量的是________mol。
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol/L标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在________(填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是________。(有关离子方程式为:8MnO![]() +5S2O
+5S2O![]() +14H+=8Mn2++10SO
+14H+=8Mn2++10SO![]() +7H2O。
+7H2O。
(4)Mg-H2O2酸性电池采用海水作电解质溶液(加入一定量的稀硫酸),该电池的正极的反应式为_______________。放电时正极附近溶液的PH________。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________,又变为棕黄色的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将ag Fe2O3和Al2O3的混合物溶解在过量的200 ml 浓度为0.1 mol/L 的盐酸溶液中,然后向其中加入NaOH溶液,使Fe3+ 、Al3+ 刚好完全沉淀,用去NaOH溶液100ml ,则NaOH溶液的浓度为 ( )
A. 0.1mol/L B. 0.2mol/L C. 0.4mol/L D. 0.8mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com