
【题目】【化学-选修3:物质结构与性质】氟及其氟产品在工农业生产中应用非常广泛,回答下列问题;
(l)基态氟原子核外电子的运动状态有______种,这些电子的电子云形状有_________种,氟原子的价电子排布式为______________。
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2晶体中所含作用力的类型有_______;与HF2-互为等电子体的分子有______(举一例)。
(3)三氟化硼乙醚(![]() )熔点-58℃,沸点126~129℃,它属于_____________晶体。
)熔点-58℃,沸点126~129℃,它属于_____________晶体。
(4)氟化钙晶胞结构如下图所示,晶胞参数a=0.555 nm。
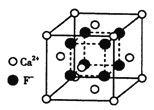
①Ca2+、F-的配位数分别为___________和___________。
②列式表示氟化钙晶体的密度________g/cm3(不必计算出结果)
【答案】(15分)(1)9、2、2s22p5(3分);
(2)离子键、共价键、氢键(2分);CO2、N2O、CS2(任写一种)(2分);
(3)分子(2分);(4)①8(2分)、4(2分);②![]() (2分)。
(2分)。
【解析】
试题分析:(1)基态氟原子核外含有9个电子,则其核外电子的运动状态有9种;氟原子核外含有2s轨道和p轨道两种轨道,则氟原子的电子的电子云形状有2种;氟原子的外围含有7个电子,其外围电子排布式为:2s22p5;
(2)NaHF2为离子化合物,存在离子键,H-F键为共价键,F的电负性较强,还存在氢键,与HF2-互为等电子体的分子有CO2(或Na2O);
(3)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,其熔沸点降低,应该属于分子晶体;
(4)①在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;在CaF2晶胞中每个F-连接4个钙离子,所以其配位数为4;
②该晶胞中含有钙离子个数=8×1/8+6×1/2=4,氟离子在该晶胞的内部,所以氟离子个数是8,该晶胞中含有4个CaF2,该晶胞的体积为:V=(5.55×10-6)3cm3,该晶胞的密度为:ρ=m/V=![]() 。
。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38, 在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:____________;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为_________molL-1
(2)常温下,浓度均为0.1molL-1的下列五种钠盐溶液的PH如下表
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是__________。根据表中数据,浓度均为0.01 molL-1的下列四种酸的溶液分别稀释100倍,PH变化最大的是___________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3) 下列说法不正确的是___ ___ ___ (填序号)
A.某温度下纯水中的c(H+)=10-6,故显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下,PH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4,4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-)是一种新型的自来水处理剂,它的性质和作用是( )
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生成在一起,故有“生命金属”之称。下列有关4822Ti和5022Ti的说法正确的是
A. 质量数相同,互为同位素
B. 质子数相同,互为同位素
C. 中子数相同,属同一种元素的不同核素
D. 核外电子数相同,中子数不同,不能互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
A. 第9列中元素中没有非金属元素
B. 只有第二列的元素原子最外层电子排布为ns2
C. 第四周期第10列元素是铁元素
D. 第15列元素原子的最外层电子排布为ns2np5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质,可利用明矾石制备氢氧化铝。
(1)已知明矾石脱水后要硫化,化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂与还原剂的物质的量之比是___________;若生成1 mol Al2O3,则转移的电子数为________。
2Al2O3+9SO2,该反应的氧化剂与还原剂的物质的量之比是___________;若生成1 mol Al2O3,则转移的电子数为________。
(2)证明废渣中含有Fe2O3 的化学方法:_____________________。
II.镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为:Mg17Al12 + 17H2=17MgH2 + 12Al ,得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
(3)熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_____________________
(4)在6.0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为_______mol。(已知:MgH2 + 2HCl = MgCl2 + 2H2↑)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
A.ΔH2>ΔH3 B.ΔH1+ΔH3=ΔH2 C.ΔH1<ΔH3 D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com