
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
A.ΔH2>ΔH3 B.ΔH1+ΔH3=ΔH2 C.ΔH1<ΔH3 D.ΔH1+ΔH2>ΔH3
【答案】C
【解析】
试题分析:①胆矾溶于水时,溶液温度降低,反应为CuSO45H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H1>0;②硫酸铜溶于水,溶液温度升高,该反应为放热反应,则:CuSO4(s)=Cu2+(aq)+SO42-(aq)△H2<0;③已知CuSO45H2O(s)=CuSO4(s)+5H2O(l)△H3;依据盖斯定律①-②得到③:△H3=△H1-△H2,由于△H2<0,△H1>0,则△H3>0;A.上述分析可知:△H2<0,△H1>0,则△H2<△H3,故A错误;B.△H3=△H1-△H2,则△H1=△H3+△H2,故B错误;C.分析可知△H3>0,而△H2<0,则△H3>△H1,故C正确;D.△H2<0,△H1>0,且△H1=△H3+△H2,则△H3>△H1+△H2,故D错误;故选C。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )
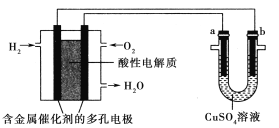
A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.电解精炼铜时,若转移1mol电子,a极质量减少32g
C.铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的O2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨气的说法正确的是
A. 氨既能用浓硫酸干燥也能用无水CaCl2干燥
B. NH3是电解质,所以氨水能导电
C. NH3可以使干燥的红色石蕊试纸变蓝
D. 用水吸收NH3用如图装置可防止倒吸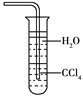
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】氟及其氟产品在工农业生产中应用非常广泛,回答下列问题;
(l)基态氟原子核外电子的运动状态有______种,这些电子的电子云形状有_________种,氟原子的价电子排布式为______________。
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2晶体中所含作用力的类型有_______;与HF2-互为等电子体的分子有______(举一例)。
(3)三氟化硼乙醚(![]() )熔点-58℃,沸点126~129℃,它属于_____________晶体。
)熔点-58℃,沸点126~129℃,它属于_____________晶体。
(4)氟化钙晶胞结构如下图所示,晶胞参数a=0.555 nm。
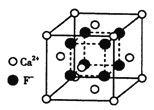
①Ca2+、F-的配位数分别为___________和___________。
②列式表示氟化钙晶体的密度________g/cm3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 原子最外层电子数为2的元素一定处于周期表ⅡA族
B. 主族元素的最高化合价与最低化合价的绝对值之和为8
C. K与水反应比Li与水反应剧烈
D. Li+和H-的离子半径相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列金属的熔沸点:
金属 | Na | Cu | Al | Fe |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点/℃ | 883 | 2595 | 2200 | 3000 |
不能形成合金的两金属是( )
A.Cu与Na
B.Fe与Cu
C.Fe与Al
D.Al与Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4 )去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比_________.
(2)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量的是________mol。
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol/L标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在________(填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是________。(有关离子方程式为:8MnO![]() +5S2O
+5S2O![]() +14H+=8Mn2++10SO
+14H+=8Mn2++10SO![]() +7H2O。
+7H2O。
(4)Mg-H2O2酸性电池采用海水作电解质溶液(加入一定量的稀硫酸),该电池的正极的反应式为_______________。放电时正极附近溶液的PH________。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________,又变为棕黄色的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
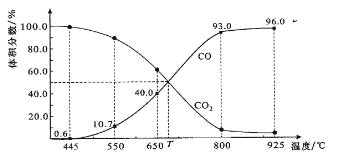
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com