
【题目】海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程中的一部分。
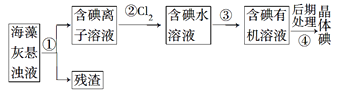
下列判断正确的是
A. 步骤①③的操作分别是过滤、萃取
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是裂化汽油或乙醇
D. 步骤④的操作是过滤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性。下列叙述中不正确的是:
A. 红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟
B. 钠在氯气中燃烧,生成白色的烟
C. 纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾
D. 氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案、现象、得出的结论均正确的是
选项 | 实验及现象 | 结论 |
A | 向SiO2固体加入过量盐酸振荡,固体不溶解 | SiO2不溶于任何酸 |
B | 用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰 | 该样品含钠元素 |
C | 向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 白色沉淀为BaSO3 |
D | 将镁条点燃,迅速伸入集满CO2的集气瓶有白色固体和黑色颗粒产生 | CO2具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下图是海水综合利用的部分工业流程图:
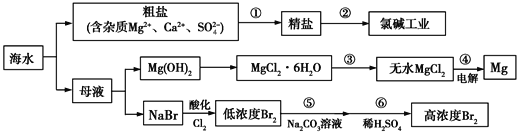
Ⅰ.在过程①中应加入的试剂分别为A.Na2CO3溶液、B.盐酸、C.BaCl2溶液、D.NaOH溶液,这4种试剂添加的合理顺序是____(填序号);过程①中须完成的实验操作分别为a.多步过滤、b.蒸发浓缩、c.冷却结晶,操作a中需要的玻璃仪器是烧杯、__________。
Ⅱ.(1)氯碱工业的反应原理是电解饱和食盐水,下列物质不可能是氯碱工业产品的是____。
A.H2 B.Cl2 C.Na2CO3 D.NaOH
(2)如图所示是离子交换膜法电解原理示意图,两极均用惰性电极材料。精制饱和食盐水进入阳极室,H+在右电极上发生____反应(填“氧化”或“还原”),所使用的离子交换膜的主要作用是____________。

(3)操作人员欲用pH试纸测定右室溶液酸碱度,其操作方法为________。
Ⅲ.过程④制取金属镁的化学方程式为MgCl2(熔融)![]() Mg+Cl2↑。简述工业上不使用电解MgO制取金属镁的原因:___。
Mg+Cl2↑。简述工业上不使用电解MgO制取金属镁的原因:___。
Ⅳ.过程⑤用纯碱溶液吸收Br2,发生的主要反应为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,则吸收1 mol Br2,转移的电子数为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)表中b_____c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为_____mol/L,0~20s内N2O4的平均反应速率为_________.
(3)该反应在80℃时该反应的平衡常数K值为_______(保留2位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4L氦气与lmol氢气所含原子数均为NA
B. 1L0.l mol/LNaHCO3溶液中含有 0.1NA个 HCO3-
C. 己知可将0.lmolNaCl溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA
D. 6molCl2通入足量热 NaOH 溶液发生反应:3Cl2+6NaOH![]() NaC1O3+5NaCl+3H2O,转移电子数目为10NA
NaC1O3+5NaCl+3H2O,转移电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量关系如图所示,符合图示情况的是( )
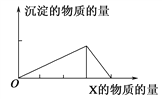
A | B | C | D | |
X | NaOH | HCl | CO2 | AlCl3 |
Y | AlCl3 | NaAlO2 | Ca(OH)2 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com