
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4L氦气与lmol氢气所含原子数均为NA
B. 1L0.l mol/LNaHCO3溶液中含有 0.1NA个 HCO3-
C. 己知可将0.lmolNaCl溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA
D. 6molCl2通入足量热 NaOH 溶液发生反应:3Cl2+6NaOH![]() NaC1O3+5NaCl+3H2O,转移电子数目为10NA
NaC1O3+5NaCl+3H2O,转移电子数目为10NA
【答案】D
【解析】
A. 标准状况下,22.4L氦气的物质的量是1mol,氦气分子是单原子分子,1mol氦气含有原子数目为NA。但氢气分子是双原子分子,lmol氢气所含原子数为2NA,A错误;
B. 1L0.l mol/LNaHCO3溶液中含有溶质NaHCO3的物质的量是0.1mol,该盐是强碱弱酸盐,在溶液中HCO3-发生水解反应而消耗,所以含有HCO3-的数目小于0.1NA个 ,B错误;
C. 0.lmolNaCl溶于乙醇中制成胶体,由于胶粒是许多NaCl的集合体,所以其中含有的胶体粒子数目小于0.1NA,选项C错误;
D.根据方程式可知每3molCl2反应转移5mol电子,则6molCl2发生该反应,转移电子的物质的量是10mol,则转移电子数目是10NA,选项D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】我国要求在全国范围内形成全民节能减排氛围。下列有关做法中不符合这一要求的是( )
A、将煤液化、气化,提高燃料的燃烧效率
B、在汽车上安装汽车尾气催化转化装置,使之发生反应:
2CO+2NO![]() 2CO2+N2
2CO2+N2
C、在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢氧燃料电池汽车
D、在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的、以离子形式存在的碘元素。下图是实验室从海藻里提取碘的流程中的一部分。
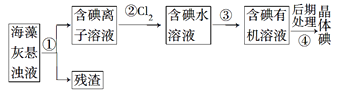
下列判断正确的是
A. 步骤①③的操作分别是过滤、萃取
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤③中加入的有机溶剂是裂化汽油或乙醇
D. 步骤④的操作是过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:

(1) ClO2中所有原子_____________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用_________
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2) 稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是_________
A.二氧化氯可广泛用于工业和饮用水处理
B.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
C.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为______________________。
(4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 __________________,此法相比欧洲方法的优点是______________________。
(5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_____________________________。此法提高了生产及储存、运输的安全性,原因是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 电解MgCl2水溶液的离子方程式:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体.请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:________.
(2)A、B、H的化学式:A__________、B__________、 H________.
(3)①H2O2分子的电子式为______________。
②写出C的酸性溶液与双氧水反应的离子方程式: _______________________。
(4)写出鉴定E中阳离子的实验方法和现象:_______________________。
(5)在C溶液中加入与C等物质的量的Na 2 O 2 ,恰好使C转化为F,写出该反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为__________________。
(2)装置A中总反应的离子方程式为____________________________。
(3)装置D中总反应的离子方程式为_____________________________。
(4)若装置E的目的是在Cu材料上镀银,则X为________,极板N的材料为__________。
(5)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为____L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氟化碘(IF5)是重要的卤氟化物,IF5可与水反应IF5+3H2O=HIO3+5HF,生成的HIO3 与KI在酸性下生成游离碘IO3-+5I-+6H+=3I2+3H2O。用标准硫代硫酸钠溶液滴定碘发生反应2Na2S2O3+I2=Na2S4O6+2NaI即可分析IF5含量,若己知滴定耗用硫代硫酸钠的物质的量为0.3mol,则分析的试样中IF5的物质的量为
A. 0.05mol B. 0.2mol C. 0.lmol D. 0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验或操作方法正确的是
A. 用蘸有待测液的铁丝,检验K+ 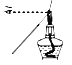
B. 从食盐水中提取氯化钠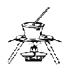
C. 验证NaHCO3和Na2CO3的热稳定性 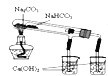
D. 分离水与乙醇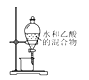
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com