
【题目】短周期元素X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的![]() 。下列说法正确的是( )
。下列说法正确的是( )

A.简单离子半径:Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X+与Y22-结合形成的化合物是离子晶体
D.Z的最高价氧化物的水化物是中强碱
【答案】D
【解析】
短周期元素X、M的族序数均等于周期序数,符合要求的只有H、Be、Al三种元素;结合分子结构图化学键连接方式,X为H元素,M为Al元素,Y原子核外最外层电子数是其电子总数的![]() ,Y为O元素,原子序数依次增大,Z元素在O元素和Al元素之间,结合题图判断Z为Mg元素,据此分析解答。
,Y为O元素,原子序数依次增大,Z元素在O元素和Al元素之间,结合题图判断Z为Mg元素,据此分析解答。
根据分析X为H元素,Y为O元素,Z为Mg元素,M为Al元素;
A.Y为O元素,Z为Mg元素,M为Al元素,简单离子的核外电子排布结构相同,核电荷数越大,半径越小,则半径:Y > Z > M,故A错误;
B.Z为Mg元素,M为Al元素,常温下Al遇浓硝酸发生钝化,不能溶于浓硝酸,故B错误;
C.X为H元素,Y为O元素,X+与Y22-结合形成的化合物为双氧水,是分子晶体,故C错误;
D.Z为Mg元素,Z的最高价氧化物的水化物为氢氧化镁,是中强碱,故D正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是( )
A.BF3与PCl3为三角锥形B.SO3与CO32-为平面三角形
C.SO2键角大于120oD.BF3是三角锥形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化和液化是高效、清洁地利用煤炭的重要途径,目前不少城市将焦炭在高温下与水蒸气反应制得水煤气,写出该反应的化学方程式_________________________说明固体煤经处理变为气体燃料使用的优点有____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
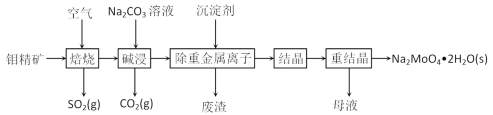
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
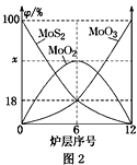
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是某条件下N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
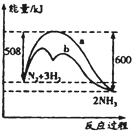
A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 正反应的活化能大于逆反应的活化能
C. b曲线是加入催化剂时的能量变化曲线
D. 使用催化剂后反应的焓变减小,N2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也有4个碳原子的单烯烃的同分异构体有( )
A. 2种 B. 4种
C. 5种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL 0.1![]()
![]() 溶液中滴加0.1
溶液中滴加0.1![]()
![]() 溶液,滴加过程中溶液中
溶液,滴加过程中溶液中![]() 与
与![]() 溶液体积(V)的变化关系如图所示,下列有关说法正确的是[已知:
溶液体积(V)的变化关系如图所示,下列有关说法正确的是[已知: ![]() ]( )
]( )
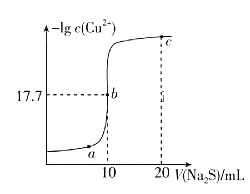
A.a、b、c三点中,水的电离程度最大的为b点
B.![]() 溶液中:
溶液中:![]()
C.该温度下![]()
D.向100mL ![]() 、
、![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了35mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL 。
(1)气态烃的分子式是__________。
(2)写出该气态烃所有同分异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是__________________。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________(填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式_________。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。
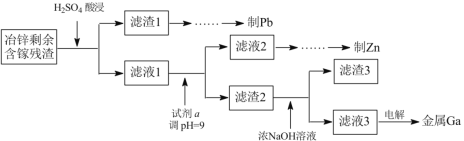
①试剂 a 是_______________。
②写出电解制镓时的阴极电极反应式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com