
【题目】图是某条件下N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
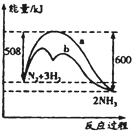
A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 正反应的活化能大于逆反应的活化能
C. b曲线是加入催化剂时的能量变化曲线
D. 使用催化剂后反应的焓变减小,N2转化率增大
【答案】C
【解析】
A.热化学方程式要标出物质的聚集状态;
B. 根据图示,正反应的活化能是508 kJ·mol-1,逆反应的活化能是600 kJ·mol-1;
C.催化剂可以降低反应的活化能;
D、正逆反应活化能之差等于焓变,催化剂不能使平衡移动。
A.热化学方程式要标出物质的聚集状态,该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3 (g) △H=-92kJ·mol-1,故A错误;
2NH3 (g) △H=-92kJ·mol-1,故A错误;
B. 正反应的活化能是508 kJ·mol-1,逆反应的活化能是600 kJ·mol-1,所以正反应的活化能小于逆反应的活化能,故B错误;
C.催化剂可以降低反应的活化能,b曲线是加入催化剂时的能量变化曲线,故C正确;
D、正逆反应活化能之差等于焓变,催化剂不能使平衡移动,加入催化剂反应的焓变不变,N2转化率不变,故D错误。


科目:高中化学 来源: 题型:
【题目】(1)下列叙述正确的是____________________
A.含有共价键的化合物一定是共价化合物
B.现已发现的零族元素的单质在常温常压下都是气体
C.第ⅥA族元素的原子,其半径越大,越容易得到电子
D.第n主族元素其最高价氧化物分子式为R2On,氢化物分子式为RHn (n≥4)
E.所有主族元素最高正化合价等于最外层电子数
F.稀有气体原子与同周期I A、ⅡA族元素的简单阳离子具有相同的核外电子排布
G.共价化合物中不可能含有离子键
H.只有非金属原子间才能形成共价键
I.非金属原子间不可能形成离子化合物
(2)写出下列物质的电子式
MgBr2 ___________________ CCl4_______________HClO_______________
N2 ___________________ NH4Cl_______________NH3_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下图判断,下列叙述正确的是( )

A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及其含硅化合物的重要原料。部分转化过程如图所示,下列说法正确的是

A. SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B. 因为在高温条件下二氧化硅与碳酸钠反应放出二氧化碳,所以H2SiO3的酸性比H2CO3强
C. SiO2在高温条件下能与过量的碳反应生成SiC,体现了二氧化硅的氧化性
D. 除Si的制取过程中涉及的反应外,图中所示其他反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的![]() 。下列说法正确的是( )
。下列说法正确的是( )

A.简单离子半径:Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X+与Y22-结合形成的化合物是离子晶体
D.Z的最高价氧化物的水化物是中强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.1000![]()
![]() 溶液中逐滴加入0.2000
溶液中逐滴加入0.2000![]() NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )

A.点a所示溶液中:![]()
B.点b所示溶液中:![]()
C.点c所示溶液中:![]()
D.点d所示溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出一点即可)。_________
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:

(1)甲装置常常浸在70~80℃的水浴中,目的是__________________________________。
(2)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_______、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在____________中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法不正确的是

A. a为铁钉,b为石墨
B. 阴极主要发生反应:2H2O + 2e-=== H2↑+ 2OH-
C. 高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-=== FeO42-+ 4H2O
D. 制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com