
【题目】Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出一点即可)。_________
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:

(1)甲装置常常浸在70~80℃的水浴中,目的是__________________________________。
(2)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_______、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在____________中。
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
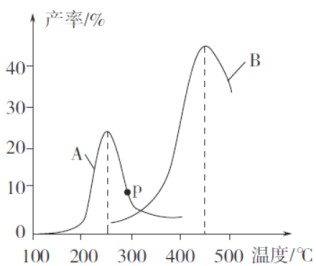
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是某条件下N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
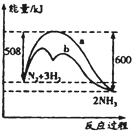
A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 正反应的活化能大于逆反应的活化能
C. b曲线是加入催化剂时的能量变化曲线
D. 使用催化剂后反应的焓变减小,N2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL 0.1![]()
![]() 溶液中滴加0.1
溶液中滴加0.1![]()
![]() 溶液,滴加过程中溶液中
溶液,滴加过程中溶液中![]() 与
与![]() 溶液体积(V)的变化关系如图所示,下列有关说法正确的是[已知:
溶液体积(V)的变化关系如图所示,下列有关说法正确的是[已知: ![]() ]( )
]( )
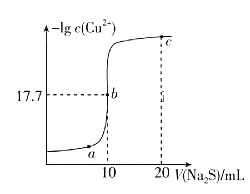
A.a、b、c三点中,水的电离程度最大的为b点
B.![]() 溶液中:
溶液中:![]()
C.该温度下![]()
D.向100mL ![]() 、
、![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙酸的性质回答下列问题:
(1)将醋酸钠晶体与浓硫酸共热,可观察到的现象为___________;反应的化学方程式为________。
(2)在滴有酚酞的氢氧化钠溶液中,逐滴加乙酸至过量,现象为_______;反应的离子方程式为_______。
(3)在碳酸钠溶液中,加入乙酸后,有________放出,反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了35mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL 。
(1)气态烃的分子式是__________。
(2)写出该气态烃所有同分异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸特性的叙述不正确的是
A. 浓硫酸具有吸水性、脱水性和强氧化性等特性
B. 浓硫酸能吸收气体中的水蒸气,常作氨气、二氧化硫等气体的干燥剂
C. 浓硫酸可以吸收固体中的湿存水、结晶水合物中的结晶水
D. 在反应C12H22O11![]() 12C+11H2O,浓硫酸作脱水剂
12C+11H2O,浓硫酸作脱水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国女科学家屠呦呦发现青蒿素(青蒿素的化学式:C15H22O5),它是一种用于治疗疟疾的药物,曾经挽救了数百万人的生命,近日获得诺贝尔生理与医学奖,成为我国获得诺贝尔科学奖的第一人。下列关于青蒿素的叙述错误的是( )
A. 青蒿素的一个分子中含有42个原子
B. 青蒿素中碳元素的质量分数约为63.8%
C. 青蒿素的相对分子质量为282
D. 0.1 mol青蒿素的质量为28.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.该反应释放CO2分子数目为![]() NA
NA
B.pH=3的草酸溶液含有H+数目为0.001NA
C.0.1molHOOC—COOH含共用电子对数目为0.9NA
D.当1molKMnO4被还原时,转移电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com