
ԭ��صĵ缫���Ʋ�����缫���ϵ������йأ�Ҳ��������Һ�йأ�����˵���в���ȷ����(����)
A����Al��Cu��ϡH2SO4���ԭ��أ��ŵ�ʱSO42����Al�缫�ƶ�
B����Mg��Al��NaOH��Һ���ԭ��أ��为����ӦʽΪ��Al��3e����4OH��===AlO2����2H2O
C����Fe��Cu��FeCl3��Һ���ԭ��أ��为����ӦʽΪ��Cu��2e��===Cu2��
D����Al��Cu��Ũ�������ԭ�������Դ����ʯī�缫�������������Һ��������1 mol Agʱ������ͭ�缫32 g

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��dz��ɫ��Fe(NO3)2��Һ�У���μ���ϡ����ʱ����Һ����ɫ�仯Ӧ��(����)
A����ɫ��dz
B������
C��û�иı�
D�����ػ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и�����Ũ�ȵĴ�С�Ƚϣ���ȷ���ǣ� ��
A��ͬŨ��������Һ�У��� (NH4)2SO4 �� NH4HCO3 �� NH4Cl �� NH3·H2O��
c(NH4��)�ɴ�С��˳���ǣ��� > �� > �� > ��
B������ʱ���������������Ͱ�ˮ��Ϻ�pH = 7����c (NH4+) > c (Cl��)
C��0.2 mol·L-1 Na2CO3��Һ�У�c (OH��) = c (HCO3��) + c (H+) + c (H2CO3)
D��0.01 mol·L-1 ��NH4Cl��Һ��0.05mol·L��1 ��NaOH��Һ�������ϣ�
c (Cl��)> c (NH4+)> c (Na+)>c (OH��)>c (H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.1mol��L��CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
A����������NaOH���壬ƽ�����淴Ӧ�����ƶ�
B�������¶ȣ�ƽ��������Ӧ�����ƶ�
C������ˮϡ�ͣ���Һ��c(H+)һ������
D����������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾΪʵ��������ɲ�ͬ�Ļ�ѧʵ����ѡ�õ�װ�û���еIJ���������û�����Դ������
| A �ⶨ�к��� | B ��ʯ��ʯ��ϡ������ȡCO2 | C ����ʯ�� | D ������Һ��ת����Һ |
|
|
|
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���
( CO2 + 3H2 = CH3OH + H2O )����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء�
��֪ H2(g)�� CO(g) �� CH3OH(l) ��ȼ���ȡ�H�ֱ�Ϊ-285.8 kJ·mol-1��-283.0 kJ·mol-1��-726.5kJ·mol-1����ش��������⣺
(1)��̫���ֽܷ�10molˮ���ĵ�������_____________kJ
(2)���ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ��ע��T1��T2������300�棩������˵����ȷ����________������ţ�
 ���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
ƽ������Ϊv(CH3OH)=  mol·L-1·min-1
mol·L-1·min-1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ ����
����
(3)��T1�¶�ʱ����1molCO2��3molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ( �� a ��ʾ )
(4)��֪�״�ȼ�յĻ�ѧ����ʽΪ2CH3OH +3O2 =2CO2 +4H2O ����ֱ���Լ״�Ϊȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ �������ķ�Ӧʽ
Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.1mol��L��CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH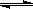 CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
A����������NaOH���壬ƽ�����淴Ӧ�����ƶ�
B�������¶ȣ�ƽ��������Ӧ�����ƶ�
C������ˮϡ�ͣ���Һ��c(H+)һ������
D����������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���
( CO2 + 3H2 = CH3OH + H2O )����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء�
��֪ H2(g)�� CO(g) �� CH3OH(l) ��ȼ���ȡ�H�ֱ�Ϊ-285.8 kJ·mol-1��-283.0 kJ·mol-1��-726.5kJ·mol-1����ش��������⣺
(1)��̫���ֽܷ�10molˮ���ĵ�������_____________kJ
(2)���ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ��ע��T1��T2������300�棩������˵����ȷ����________������ţ�
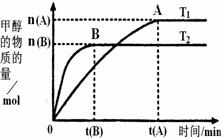 ���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
ƽ������Ϊv(CH3OH)= 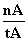 mol·L-1·min-1
mol·L-1·min-1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ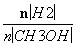 ����
����
(3)��T1�¶�ʱ����1molCO2��3molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ( �� a ��ʾ )
(4)��֪�״�ȼ�յĻ�ѧ����ʽΪ2CH3OH +3O2 =2CO2 +4H2O ����ֱ���Լ״�Ϊȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ �������ķ�Ӧʽ
Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ����Ͷ������ƣ�û�������������
A��H2O B��C6H6 C��CH3CH2OH D��CH3COOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com